ГИДРОМЕТАЛЛУРГИЯ ЦИНКА
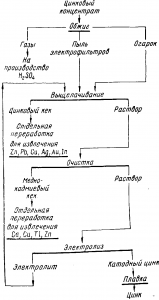
Перед выщелачиванием сульфидные концентраты обжигают в печах КС, стараясь возможно полнее окислить сульфиды и получить газы, пригодные для производства серной кислоты. Огарок выщелачивают, а растворы, очищенные от примесей, подвергают электролизу с нерастворимыми свинцовыми анодами. Катодный металл марок Ц0 и Ц1 ГОСТ 3640—65 плавят и отправляют потребителю, а отработанный электролит возвращают на выщелачивание. Все это представлено схемой рис.
Первые опыты по электролизу цинка для его производства ставились еще в начале нашего века. На Всемирной Парижской выставке 1904 г. Ашкрофт впервые показал электролитный цинк; однако применению гидрометаллургии в промышленности тогда препятствовали низкое качество сырья и высокая стоимость электроэнергии. Флотация совершенствовалась медленно, особые затруднения возникали при выделении из комплексных руд богатых цинковых концентратов с достаточно высоким извлечением в них металла. С начала первой мировой войны спрос на чистый цинк резко возрос, ректификации еще не знали, и гидрометаллургия открыла единственный путь к его получению. В 1915 г. в Канаде и США были построены первые гидрометаллургические заводы, но доля их продукции в мировой металлургии цинка весьма мала. За рубежом электролиз медленно завоевывал признание вследствие желания полнее использовать капиталовложения в дистилляционное производство, дороговизны электроэнергии и недостаточного спроса на чистый металл.
Рис. Краткая схема гидрометаллургии цинка
За последние десятилетия производство электролитного цинка удалось значительно усовершенствовать: сырье стало богаче и чище, стоимость энергии снизилась. Вместе с тем успехи в области дистилляции не приводили к коренным усовершенствованиям и она все более проигрывала в сравнении с гидрометаллургией. В период с 1960 по 1970 г. доля цинка, выплавляемого пирометаллургическими способами, сократилась до 44%, в том числе в горизонтальных ретортах до 25% и продолжает снижаться.
В нашей стране первый опытный гидрометаллургический завод начал работать в 1933 г., за ним возникли другие уже крупные предприятия. Оставшиеся от царской России небольшие дисгаяляционные установки вскоре приобрели второстепенное значение, а затем стали преимущественно опытными базами для изучения новых переделов. Основное количество цинка в России выдают гидрометаллургические заводы.
Сульфидные концентраты обжигают (см. рис.), а окись цинка выщелачивают из огарка оборотным раствором, в котором приблизительно 0,5 моль/л серной кислоты и 60 г/л цинка.
К концу выщелачивания концентрация последнего достигает 130 г/л:
ZnO + H2SО4 = ZnSО4 + Н2О
Константу равновесия этой реакции в ионном виде, выражаемую отношением
можно вычислить по формулам (4) или (122), полагая во втором случае ПРZnO≈ПРZn(OH)2
По уравнению (4)
ΔZ0H2O + ΔZ0ZN2+ — ΔZ0ZnO = ΔZ0(194)
—237,5 — 146,6 + 320,9 = — 63,2 кДж.
Применив формулу (19), при 298 К получим lgK=11 K=1011
По уравнению
рК = рПРZn(OH)2—2рКH2O= — 10,85; K = 1,4 • 1011
Считая первую цифру более достоверной, вычислим из нее равновесную активность Н+ в двухмолярномр растворе сульфата цинка, получаемом в конце выщелачивания (323 г/л Z11SO4). Молярность в данном случае практически равна мо-ляльности, приняв плотность раствора равной 1360 кг/м3, найдем
т = ((2 • 1000): 1360 — 323 = 1,92 молей на 1000 г воды
Коэффициент активности ZnSO4 в 2-м растворе известен
γ±=0,0357. Далее из К(194) получим
Расчет показывает, что выщелачивание возможно с весьма полным использованием серной кислоты — конечный раствор почти нейтрален.
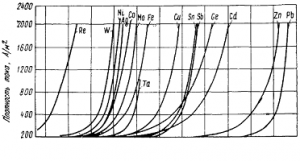
Примеси понижают перенапряжение водорода на цинке (рис. 2) и выход его по току. Перед электролизом их необходимо удалить.
Рис. 2. Перенапряжение водорода на некоторых металлах в растворе 2-н. серной кислоты при температуре 25° С
Не останавливаясь здесь на очистке от примесей (она рассмотрена ниже), обратимся к электролизу, который можно описать реакцией:
2ZnSO4 + 2Н2O = 2Zn + 2H2SO4 + O2 + ΔZ0
или в ионном виде:
2Zn2+ + 2Н2О = 2Zn + 4Н+ + О2 + ΔZ0,
Д2° = 268 кДж = 0,213 кВт•ч.
Теоретически для получения 1 т цинка требуется 1629 кВт-ч, практически ~ 3100 кВт•ч, причины этого пояснены ниже. Пока заметим, что на перевод в раствор 1 г-атома цинка по реакции (194) затрачивается ровно столько же серной кислоты, сколько ее выделяется при электролизе. Казалось бы, производство возможно без затрат H2SO4; однако, учитывая неизбежные потери, обжиг ZnS ведут с образованием небольшого количества растворимого в воде ZnSО4, для которого кислоты не требуется и он поэтому восполняет ее потери.
Статья на тему Гидрометаллургия цинка

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.