Коррозия металлов это необратимый процесс окисления поверхности металлов, которая происходит от химического взаимодействия например железа с водой.
Процессы коррозии могут пыть ускорены некоторыми факторами например присутствие в воздухе окислов азота или серы, соприкосновение с окислителями например нитрат аммония, излучения, повышенная температура и т.д.
А также очень важный фактор это прохождение через металлы электрического тока.
Что такое коррозия металла
Почти все металлы, приходя в соприкосновение с окружающей их газообразной или жидкой средой, более или менее быстро подвергаются с поверхности разрушению.
Причиной его является химическое взаимодействие металлов с находящимися в воздухе газами, а также с водой и растворенными в ней веществами.
Всякий процесс химического разрушения металлов под действием окружающей среды называется коррозией.
Проще всего протекает коррозия при соприкосновении металлов с газами.
На поверхности металла образуются соответствующие соединения: окислы, сернистые соединения, основные соли угольной кислоты.
Которые нередко покрывают поверхность плотным слоем, защищающим металл от дальнейшего воздействия тех же газов.
Коррозия металлов в жидкой среде
Иначе обстоит дело при соприкосновении металла с жидкой средой — водой и растворенными в ней веществами.
Образующиеся при этом соединения могут растворяться, благодаря чему коррозия распространяется дальше вглубь металла.
Кроме того, вода, содержащая растворенные вещества, является проводником электрического тока.
Вследствие чего постоянно возникают электрохимические процессы, которые являются одним из главных факторов, обусловливающих и ускоряющих коррозию.
Влияние примесей
Чистые металлы в большинстве случаев почти не подвергаются коррозии. Даже такой металл, как железо, в совершенно чистом виде почти не ржавеет.
Но обыкновенные технические металлы всегда содержат различные примеси, что создает благоприятные условия для коррозии.
Чтобы понять, почему примеси влияют на коррозию металлов, посмотрим, что происходит, когда два различных металла соприкасаются друг с другом, находясь во влажном воздухе.
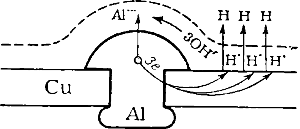
Положим, например, что в медном листе находится алюминиевая заклейка (рис.).
Так как все твердые тела адсорбируют на своей поверхности влагу из воздуха, то и поверхность наших металлов будет покрыта тончайшей пленкой воды.
Но вода, как известно, диссоциирует, хотя и в ничтожной степени, на ионы Н• и ОН’; кроме того, растворенный в воде углекислый газ образует угольную кислоту, диссоциирующую по уравнению:
Н2СО3 ⇄ Н• + НСО3
Следовательно, медь и алюминий будут как бы погружены в раствор, содержащий ионы H•, ОН’ и НСО3‘.
Получается гальванический элемент, в котором отрицательным электродом служит алюминий, а положительным — медь.
Ввиду тесного соприкосновения обоих металлов элемент этот замкнут и непрерывно работает.
Алюминий посылает свои ионы в раствор, а избыточные электроны переходят к меди, у поверхности которой они разряжают ионы водорода.
В растворе ионы Аl••• соединяются с ионами ОН’, образуя Аl(ОН)3, выделяющийся у поверхности алюминия:
2Аl — 6е— = 2Аl••• 6Н• + 6e— = 3Н2
2Аl••• + 6OН’ = 2Аl(ОН)3
Таким образом, алюминий довольно быстро подвергается коррозии.
Коррозия железа
Несколько сложнее происходит коррозия железа, находящегося в контакте с каким-нибудь менее активным металлом, например с той же медью.
Железо посылает в раствор двухвалентные ионы Fe••, которые, соединяясь с гидроксильными ионами, превращаются в Fе(ОН)2.
В то же время электроны железа переходят к меди и разряжают у ее поверхности ионы водорода.
Рис. 2. Растворение в кислотах химически чистого цинка при контакте с медной или платиновой проволочкой.
В присутствии кислорода воздуха и воды Fe(ОН)2 окисляется в гидрат окиси железа Fe(OH)3, образующий ржавчину:
4Fe(OH)9 + 2Н2О + О2 = 4Fe(OH)3
В разобранных нами случаях причиной коррозии алюминия и железа являлся контакт с менее активным металлом — медью.
Такую же роль, как и медь, играют различные примеси, всегда содержащиеся в технических металлах и обусловливающие их коррозию.
Например, обыкновенная сталь при исследовании ее под микроскопом оказывается состоящей из мелких зерен чистого железа, тесно перемешанных с зернами карбида железа — цементита Fe3C — и других примесей.
Получается бесконечное множество так называемых гальванических пар, в которых зерна цементита играют роль положительных электродов, а зерна железа — отрицательных.
При соприкосновении с влажным воздухом возникают гальванические токи, вызывающие коррозию стали.
Аналогичным образом примеси способствуют коррозии и других металлов.
Почему происходит коррозия металлов
Коррозия алюминия, цинка, железа и вообще металлов, стоящих в ряду напряжений слева от водорода, сводится по существу к вытеснению ионов водорода из раствора и переходу самого металла в раствор в виде ионов.
Ускоряющее влияние контакта с менее активным металлом при таких процессах можно наглядно иллюстрировать следующим опытом.
В пробирку с разбавленным раствором кислоты бросим кусочек химически чистого цинка. Выделения водорода почти не наблюдается.
Отсутствие реакции объясняется тем, что начинающие переходить в раствор ионы Zn•• гидратируются и образуют вокруг цинка слой положительно заряженных ионов.
Этот слой не дает возможности ионам водорода подходить вплотную к поверхности цинка и получать от него электроны, вследствие чего дальнейшее растворение цинка приостанавливается.
Но стоит только коснуться поверхности цинка платиновой или медной проволочкой, как вследствие образования гальванической пары тотчас же начинается энергичное выделение водорода у поверхности проволочки.
Электроны переходят от цинка к платине (или меди) и с нее на ионы водорода, а цинк постепенно растворяется, посылая новые ионы в раствор (рис. 2).
Такой же эффект вызывает прибавление к раствору кислоты нескольких капель раствора сернокислой меди CuSO4.
Цинк вытесняет медь и покрывается с поверхности рыхлым слоем металлической меди. Получается гальваническая пара цинк —медь, работающая, как в элементе Вольта.
Поэтому «омедненный» цинк энергично вытесняет водород из кислоты, но выделение водорода происходит у поверхности меди, а не у поверхности цинка (рис. 3).
Продажный цинк, содержащий примеси, действует аналогичным образом.
На скорость растворения металла в кислоте, помимо примесей, влияют и другие факторы: структура металла, способ его обработки, свойства кислоты и т. п.
Но во всех случаях процесс растворения может быть замедлен прибавлением к кислоте некоторых веществ, главным образом органических, получивших название ингибиторов (замедлителей коррозии).
Ингибиторы

Действие ингибиторов иногда настолько эффективно, что некоторые металлы и сплавы становятся практически нерастворимыми в кислотах, к которым прибавлен соответствующий ингибитор.
Замедляя растворение металла, ингибиторы в то же время совершенно не влияют на скорость растворения окислов металлов, их гидроокисей и других веществ.
Поэтому прибавление ингибиторов позволяет освобождать с помощью кислот поверхность металла от покрывающих ее соединений (например, удалять ржавчину с железа, накипь со стенок котлов), почти не затрагивая самого металла.
Так как элементы расположены в ряду напряжений по убывающей активности, то следовало бы ожидать, что чем левее стоит элемент в ряду напряжений, тем легче он будет подвергаться коррозии.
В действительности это не всегда имеет место. Например, алюминий, стоящий недалеко от начала ряда, довольно хорошо сопротивляется атмосферной коррозии.
Коррозия алюминия
Причиной такой устойчивости является образование на поверхности алюминия тонкой, но очень плотной и эластичной пленки окиси алюминия, предохраняющей алюминий от соприкосновения с окружающей средой.
И действительно, стоит только тем или иным способом уничтожить эту пленку, как алюминий начинает быстро корродировать.
Смочим хорошо вычищенную наждачной бумагой алюминиевую пластинку раствором сулемы HgCl2. Алюминий вытесняет ртуть, которая образует с ним сплав — ртутную амальгаму, препятствующую возникновению защитной пленки.
Поэтому оставленная на воздухе пластинка быстро покрывается рыхлыми хлопьями гидрата окиси алюминия — продуктом коррозии алюминия.
В данном случае коррозия усиливается еще и вследствие контакта алюминия с малоактивным металлом — ртутью.
Понятно, что образующийся на поверхности металла слой окислов или каких-либо других соединений может служить защитой только в том случае, если он является достаточно плотным, прочным и нерастворимым в воде.
В противном случае он не может помешать коррозии. Так, например, появляющаяся на железе ржавчина совершенно не защищает его от дальнейшей коррозии.
Так как слой ее оказывается очень рыхлым, хрупким и слабо пристающим к поверхности металла.
Пассивирующие агенты
Вещества, способствующие возникновению на металле защитной пленки, носят название пассивирующих агентов.
Таковыми для большинства металлов являются сильные окислители. Для железа хорошим пассивирующим агентом служат также ионы ОН’.
Как уже указывалось раньше , многие довольно активные металлы становятся пассивными после обработки их концентрированной азотной кислотой вследствие образования на поверхности металла тончайшего невидимого слоя окиси, препятствующего дальнейшему окислению.
Существование таких «оксидных пленок» доказано различными методами: поляризацией отраженного света, рентгенографическим путем и др.
Теория «оксидных пленок» была подробно развита в начале нынешнего столетия В. А. Кистяковским (1865—1952), работы которого имели большое значение для борьбы с коррозией.
Некоторые вещества разрушают или ослабляют защитную пленку металла, тем самым способствуя коррозии.
Такие вещества называются активирующими агентами или активаторами.
Наиболее энергичным активатором для всех металлов является ион Cl. Быстрое разрушение подводных металлических частей морских судов объясняется главным образом присутствием ионов Сl’ в морской воде.
Очень энергичными активаторами для многих металлов являются ионы водорода.
Кислород, растворенный в воде, также сильно ускоряет коррозию, связывая первичные продукты реакции (например, окисляя Fe(OH)2 в Fe(OH)3 в случае коррозии железа) и тем самым предотвращая возможность обратной: реакции.
Убытки, причиняемые коррозией металлов, огромны. Вычиcлено, например, что вследствие коррозии ежегодно гибнет такое количество железа, которое равно приблизительно 1/4 всей мировой его добычи за год.
Поэтому изучению процессов коррозии металлов и отысканию наилучших средств ее предотвращения уделяется очень много внимания.
Способы борьбы с коррозией
Способы борьбы с коррозией чрезвычайно разнообразны. Наиболее простой из них заключается в защите поверхности металла от непосредственного соприкосновения с окружающей средой путем покрытия масляной краской, лаком, эмалью или, наконец,, тонким слоем другого металла.
Особенный интерес с теоретической точки зрения представляет покрытие одного металла другим. Посмотрим, к каким результатам оно приводит.
Так как коррозия всегда возникает на поверхности металла, то до тех пор, пока слой защищающего металла является сплошным, изделие ведет себя так, как если бы оно целиком состояло из защищающего металла.
Но если в защитном слое появляются царапины, трещины и т. п., обнажающие поверхность защищаемого металла, то в этих местах сейчас же создаются условия, благоприятствующие коррозии.
Однако процесс коррозии будет протекать совершенно различно в зависимости от относительного положения обоих металлов в ряду напряжений.
Защита металла от коррозии оловом
Разберем случай так называемого катодного покрытия, когда защищающий металл стоит в ряду напряжений правее защищаемого.
Типичным примером может служить коррозия луженого, т.е. покрытого оловом, железа (белая жесть).
Олово само по себе очень устойчиво и хорошо защищает металл, пока слой его на железе является сплошным.
При нарушении целостности защитного слоя и соприкосновении обнаженного места с влагой образуется гальваническая пара, в которой положительным электродом (катодом) служит олово , а отрицательным (анодом) —железо.
Поток электронов направляется от обнаженной поверхности железа к олову и здесь разряжает ионы водорода, а железо подвергается разрушению, посылая все новые и новые ионы в раствор (рис. 4, а).
Таким образом, в месте повреждения луженое железо ржавеет гораздо быстрее, чем нелуженое.
Защита металла от коррозии цинком

Совершенно иначе протекает коррозия, если защищающий металл стоит в ряду напряжений левее защищаемого, как, например, при покрытии железа цинком (анодное покрытие).
В этом случае при повреждении защитного слоя тоже получается гальваническая пара, но теперь железо служит катодом, а анодом — цинк, и электроны переходят от цинка к железу; поэтому цинк разрушается, а железо остается защищенным (рис. 4, б).
Защита действует до тех пор, пока не будет разрушен весь слой цинка, на что потребуется довольно много времени.
Защита металла от коррозии хромом
Хром — это химически стойкий металл, обладающий высокой твердостью и износоустойчивостью.
Хром относится к числу электроотрицательных металлов (φ°Cr/Cr3+ = — 0,74 в) однако обладает сильной склонностью к пассивированию, благодаря чему приближается по стойкости к благородным металлам.
Так, органические кислоты, сера, сероводород, серная кислота, азотная кислота, растворы щелочей на него не действуют.
Электролитический хром обладает высокой твердостью. Твердость хрома, выраженная в единицах Бриннеля, достигает 1000— 1100 кгс/мм2 .
Хромирование производят на практике из электролита, содержащего в качестве основного компонента не соль хрома, как в большинстве гальванических процессов, а хромовый ангидрид.
Водный раствор хромового ангидрида представляет смесь полихромовых кислот, в основном Н2СrО4 и Н2Сr2О7,
Хромирование широко применяют для повышения износостойкости мерительного инструмента, калибров, режущего инструмента (сверла, развертки и т. п.), прессформ, трущихся деталей приборов и машин.
Чем покрывать метал от коррозии
Из сказанного ясно, что для защиты от коррозии целесообразнее покрывать поверхность металла слоем более активного металла, чем слоем менее активного.
Однако другие соображения нередко заставляют применять также покрытия из менее активных металлов.
На практике чаще всего приходится принимать меры к защите железа, как металла, особенно подверженного коррозии.
Кроме цинка, из более активных металлов для этой цели иногда применяют кадмий, действующий подобно цинку.
Из менее активных металлов для покрытия железа чаще всего применяют олово, медь и никель.
Покрытые никелем железные изделия имеют красивый вид, чем объясняется широкое распространение никелирования.
При повреждении слоя никеля коррозия происходит менее-интенсивно, чем при повреждении слоя меди (или олова), так как разность потенциалов для пары никель — железо гораздо меньше, чем для пары медь — железо.
Из других способов борьбы с коррозией упомянем еще о способе, протекторов, заключающемся в том, что защищаемый металлический объект приводится в контакт с большой поверхностью более активного металла.
Так, в паровые котлы вводят листы цинка, находящиеся в контакте со стенками котла и образующие с ними гальванический элемент.
Часто задаваемые вопросы ответы?
Почему происходит коррозия металлов?
Коррозия происходит потому, что на поверхности металлов начинаются необратимые химические процессы окисления, которые могут быть ускорены множеством факторов или совокупность этих факторов.
Например повышенная кислотность, повышенное содержание окисей серы и азота, присутствие солей которые в присутствии влаги и электрического тока в разы повышают коррозию металла.
Как бороться с коррозией?
Для этого на поверхность наносят слой краски, который предотвращает дальнейшее химическую реакцию между агрессивной средой и металлом.
Или наносят с помощью химической реакции или электролиза слой другого металла, который и защищает сам металл (например это цинк, медь, кадмий, хром, отсюда цинкование, кадмирование, хромирование).
Также для этих целей иногда наносят слой благородного металла например серебро, палладий, золото, платина.
Соединения этого элемента являются дешёвыми и эффективными ингибиторами коррозии. они окисляют поверхность железа, образуя защитный слой, не подвергающийся дальнейшему окислению. но в то же время данные соединения являются канцерогенами. известен случай их опасного действия на людей: компания pacific gas and electric company незаконно сбрасывала данные соединения в природные водоёмы и впоследствии?
Ответ: Это соединение хрома, а точнее хромовая кислота, т. е. шестивалентный хром. Это происходит потому, что хром хорошо сопротивляется окислению на воздухе и действию кислот.
Его часто наносят на поверхность других материалов, чтобы защитить их от коррозии. Подробнее.
Статья на тему Коррозия металлов



Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.