Сероводород — бесцветный газ с запахом тухлых яиц. При — 60 °С превращается в жидкость, а при —86 °С затвердевает. Водный раствор сероводорода называется сероводородной кислотой.
Образуется при гниении белковых органических веществ, всегда содержится в вулканических газах, иногда содержится в некоторых видах минеральных вод.
На глубине выше 200 метров на Чорном море образуется некоторыми микроорганизмами.
Сероводород: свойства, применение и реакции
Сероводород H2S — важнейшее водородное соединение серы , в котором она проявляет степень окисления -2 .
Так же известны многосероводороды H2Sx(H2S2, H2S3 и др .)
Сероводород — бесцветный газ с сильным неприятным запахом, ядовит и вызывает отравление (если 1 часть H2S приходится на 2000 частей воздуха).
Так как с железом гемоглобина крови образует сульфид железа, противоядие вдыхание свежего воздуха с примесью хлора.
Сероводород горит голубоватым пламенем , окисляясь до двуокиси серы:
2H2S + 3O2 = 2SO2 + 2H2O
Смеси сероводорода с воздухом очень опасны при поджигании.
При недостатке кислорода ( или охлаждении пламени ) сероводород окисляется до свободной серы:
2H2S + O2 = 2S + H2O
Свойства
В окислительно — восстановительных реакциях сероводород играет роль сильного восстановителя, может окисляться до свободной серы , двуокиси и трёхокиси серы.
Хлор, азотная кислота, дихромат K2Cr2O7 и перманганат калия KMnO4 окисляют сероводород до свободной серы.
Рис. Диполь в молекуле сероводорода.
При 20°C в 1 объёме воды растворяется 2,4 объёма сероводорода и получается сероводородная вода, которая при стоянии быстро мутнеет из за выделения свободной серы.
В водных растворах сероводород ведёт себя как слабая двухосновная кислота, которая диссоциирует в две ступени:
H2S ⇄ H⁺ + HS ⁻
HS⁻ ⇄ H⁺ + S²⁻
Получение
Сероводород можно синтезировать :
H + S ⇄ H2S ΔH°298 = — 20,09 кДж/ моль
однако эта реакция обратима и неудобна для практических целей.
В лаборатории сероводород получают действием на сульфид железа разбавленной соляной кислотой и серной кислотой :
FeS +2HCl = H2S↑ + FeCl2
В промышленности — при коксовании угля и очистке нефтепродуктов.
Соли
Средние соли сероводородной кислоты — сульфиды — иногда получают соединением серы с металлом, но чаще действием сероводорода на растворы солей:
ZnSO4 + H2S = ZnS↓ + H2SO4
Zn⁺ + H2S = ZnS↓ + 2H↑
Сульфиды тяжёлых металлов малорастворимы в воде, имеют характерную окраску : сульфид цинка ZnS — белую , меди CuS — черную , кадмия CdS — жёлтую , ртути HgS — красного цвета.
Благодаря этому они служат основой для изготовления некоторых красок. Сульфиды калия , кальция и бария используются в кожевенном производстве для удаления шерсти со шкур.
Сульфиды аммония (NH4)2S, щелочных (Na2S, K2S) и щелочно земельных металлов (BaS, CaS) хорошо растворимы в воде.
Полисульфиды
Растворы их, растворяют серу с образованием многочисленных полисульфидов : от Na2S2 до Na2S5 или CaS2 до CaS5.
Полисульфиды содержат атомы серы — S — S — S — , но они не прочны и под действием кислот (соляная кислота) разлагается с выделением избыточной серы и сероводорода:
Na2S2 + 2HCl = S + H2S↑ + 2NaCl
Некоторые полисульфиды использовались как инсектициды.
Реакции
Сероводород реагирует:
2H2S + O2 = 2Н2О +2S,
2H2S + ЗО2 = 2Н2О + 2SO2,
H2S + 2КОН = K2S + 2Н2О,
H2S + CuSO4 = CuS + H2SO4,
H2S + Cl2 = 2HCI + S,
H2S + 2FeCI3 = 2FeCl2 + 2HCl + S,
H2S + H2SO4 = 2H2O + S + SO2.
Быстрые ответы?
Воздействует в первую очередь на нервную систему, вызывает сильные головные боли, судороги и может привести к коме.
Смертельная концентрация сероводорода составляет примерно 1000 мг/м3.
Входит в состав природного и вулканических газов, где его содержание особенно высоко.
Образуется в результате жизнедеятельности некоторых бактерий в Чорном море.
Для нейтрализации в воздухе используют скруббер (газопромыватель), а также можно использовать парообразную воду.


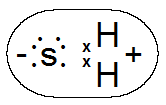
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.