Сплав это вещество, которое образуется при соединении двух или более металлов. Они также могут образовываться при соединении металлов с другими элементами.
Однако свойства, которые проявляют сплавы, отличаются от индивидуальных свойств этих элементов. Когда вы сравниваете его с чистыми металлами, сплавы становятся прочнее и тверже.
Примеры сплавов включают красное золото, которое изготавливается путем объединения золота и меди вместе.
Другой пример сплава включает белое золото, которое представляет собой слияние серебра и золота.
Что такое сплавы
Металлы нерастворимы в обычных растворителях: воде, спирте, эфире и др., но в расплавленном состоянии могут взаимно растворяться или смешиваться друг с другом, образуя сплавы.
Большинство расплавленных металлов смешивается в любых пропорциях, подобно тому, как смешивается спирт с водой. Но некоторые металлы растворяются один в другом лишь до известной степени.
Например, если смешать расплавленные цинк и свинец, то при отстаивании смеси образуется два слоя: нижний — свинец, в котором растворено немного цинка, верхний — цинк, содержащий некоторое количество свинца.
При сплавлении металлов происходит или простое растворение одного металла в другом, или, что чаще, металлы вступают в химическое соединение.
Поэтому сплавы обычно представляют собой смеси свободных металлов с их химическими соединениями.
Образование которых нередко сопровождается значительным тепловым эффектом. Например, при погружении алюминия в расплавленную медь выделяется столько тепла, что вся масса сплава раскаляется добела.
Все металлы образуют сплавы с другими металлами сплавы, а также с другими простыми веществами примеры: Золота сплавы, Серебряно золотой сплав, Серебра сплавы, Сплавы железа, Литий содержащие сплавы, Медно-никелевые сплавы, Меди сплавы, Вольфрамовые сплавы, Молибдена сплавы, Хрома сплавы, Алюминия сплавы, Индий сплавы, Лантан сплавы и т.д.
Сплав что это такое
Многие металлы образуют по несколько различных соединений друг с другом, как, например, AuZn, Au3Zn5, AuZn3, Na4Sn, NaSn, NaSn2 и др.
Твердые сплавы иногда совершенно однородны: в таком случае они представляют собой или определенное химическое соединение, или однородную смесь неопределенного состава, называемую твердым раствором.
Последний образуется, если атомы смешиваемых металлов могут замещать друг друга в кристаллической решетке, не нарушая ее структуры.
Благодаря такой замене получаются совершенно однородные смешанные кристаллы, содержащие одновременно атомы обоих металлов и обусловливающие полную однородность сплава.
Большинство сплавов, однако, неоднородно и состоит из кристаллов отдельных металлов, смешанных с кристаллами химических соединений металлов (если такие соединения образуются при сплавлении).
Металлы образуют сплавы не только друг с другом, но также и с некоторыми металлоидами; например, чугун и сталь представляют собой сплавы железа с углем.

Если сплавляемые металлы не образуют химических соединений или твердого раствора, то при охлаждении сплава один из компонентов начинает выделяться в твердом виде.
Например, если охлаждать жидкий сплав, состоящий из 10 весовых частей свинца и 90 весовых частей олова.
То сперва выделяются кристаллы чистого олова совершенно так же, как при замерзании разбавленного раствора сахара в воде сначала выделяется чистый лед.
Температура, при которой начинается выделение олова из сплава, лежит ниже, чем температура затвердевания чистого олова.
Определив понижение температуры затвердевания олова при растворении в нем свинца, можно вычислить молекулярный вес последнего, руководствуясь теми же правилами, что и для водных растворов.
Таким путем были определены молекулярные веса многих металлов, причем оказалось, что металлы в разбавленных металлических растворах большей частью существуют в виде отдельных атомов.
Определение сплава
Сплав относится к комбинации двух или более металлов или металла в сочетании с одним или несколькими элементами.
Полученный сплав обладает свойствами, отличными от исходных элементов в целом, такими как повышенная прочность и твердость.
Например, когда элементарное железо соединяется с неметаллическим кремнием или углеродом, получается сталь или силиконовая сталь.
Для определения состава сплавов методы химического анализа мало пригодны, так как во многих случаях невозможно выделить из сплава образующиеся соединения металлов.
Поэтому при изучении сплавов на первом месте стоят физические методы исследования. В разработке этих методов выдающаяся роль принадлежит русскому ученому Н. С. Курнакову, создавшему новую научную дисциплину —физико-химический анализ.
Физико-химический анализ сплавов
Физико-химический анализ позволяет количественно исследовать ход изменения какого-либо физического свойства (давления пара, температуры плавления, уд. веса, вязкости, электропроводности и т. п.) системы, образованной обычно двумя веществами при непрерывно меняющемся ее составе.
Результаты исследования наносят на диаграмму состав—свойство, причем состав всегда откладывается по горизонтальной оси и выражается в процентах одного из компонентов (составных частей) системы.
А свойство, выраженное числовым значением соответствующей физической константы, — по вертикальной оси.
Такие диаграммы позволяют по виду полученных кривых не только обнаруживать происходящие в системе превращения.
Но и дают указания относительно характера с этих превращений, состава получающихся продуктов, образования твердых растворов и т. д.
В настоящее время методами физико-химического анализа широко пользуются в металлургической, силикатной, химической и других отраслях промышленности.
Компоненты сплава
Сплав состоит из двух или более элементов, либо в виде соединения, либо в виде раствора. Компонентами сплавов, как правило, являются металлы.
Однако углерод является исключением из того, что он является неметаллическим и важным компонентом стали. Сплавы обычно получают, когда смесь их составляющих расплавляется.
Свойства сплава
Сплав это вещество, обладающее металлическими свойствами и состоящее из двух или более элементов, из которых по крайней мере один является металлом.
Металл, обладающий металлическими свойствами, это материал, который, будучи свежеприготовленным, расколотым или отполированным, демонстрирует блестящий внешний вид.
Он также проводит тепло и электричество.
Металлы, как правило, податливы, а это значит, что их можно легко забивать в тонкие листы. Они также пластичны, что означает, что их также можно втягивать в провода.
Металл может быть либо химическим элементом, таким как железо, либо сплавом, таким как нержавеющая сталь.
Большинство чистых металлов либо очень хрупкие, мягкие, химически реакционноспособные для практического использования.
Когда различные соотношения металлов объединяются в сплавы, это изменяет исходные свойства металлов, чтобы придать им желаемые характеристики.
Сплавы, как правило, изготавливаются для того, чтобы они были менее хрупкими, устойчивыми к коррозии, более твердыми или даже имели более желательный блеск и цвет.
Поэтому легирование металла помогает нам использовать металл в повседневной жизни. Этот процесс также помогает сделать различные типы металлов идеальными для использования (путем изменения их свойств ).
Примеры сплавов
Сталь
Сталь это сплав углерода и железа. Это популярный сплав из-за его низкой стоимости и более высокой прочности на растяжение.
Однако многие различные типы сталей состоят из различного количества углерода наряду с несколькими другими элементами, такими как марганец, фосфор, сера, хром, медь, никель и молибден.
В первую очередь, состав железа определяется железом, которое составляет не менее 75% от общего веса сплава.
Он также состоит из различного количества углерода и многих других элементов в зависимости от типа стали.
Поскольку сталь обладает более высокой прочностью на растяжение и доступностью по цене, она используется в инфраструктуре и строительстве зданий, кузовов транспортных средств и электроприборов.
Бронза
Бронза, как известно, представляет собой сплав олова и меди. Он обычно используется в тяжелых инструментах и механизмах, монетах, медалях, трофеях и даже в различных видах электрооборудования.
Прочность бронзы варьируется в зависимости от сплавов, которые используются при легировании. Вы должны знать, что бронза намного превосходит чистую медь по твердости.
Он также более пластичен и поддается механической обработке по сравнению с чистой медью.
Нихром
Нихром это сплав хрома и никеля. Однако также часто сплавы нихрома состоят из железа и других подобных элементов. Нихром в основном используется в проводах сопротивления.
Он также находит применение в нескольких электроприборах, таких как хлебные тостеры и обогреватели. Нихромовые сплавы также используются в зубных пломбах.
Латунь
Латунь это сплав меди, очень распространенный и полезный. При этом количество цинка сохраняется на уровне 45%. Наряду с цинком, такие металлы, как Sn , Mn , Al,Fe, Pb и т.д.,
Также добавляются в небольшом количестве для получения некоторых специальных свойств.
Существует много видов латуни. Все они имеют различный состав меди. Например — латунь мюнца, морская латунь, алюминиевая латунь, немецкое серебро, обычная латунь, колпачковая медь и т.д.
Эти сплавы обладают большой прочностью, долговечностью и обрабатываемостью по сравнению с обычной медью. Кроме того, их температура плавления ниже, чем у меди и цинка.
Эти сплавы также подвержены коррозии, воде устойчивы и имеют хороший срок службы. Латунь используется в изготовлении ювелирных изделий , поковок, заклепок, шурупов.
Патронная латунь в основном используется для изготовления листов и труб. Эти сплавы также используются для изготовления декоративных изделий и судовых гребных валов.
Пример получения сплава
Первый сплав содержит 5% меди, второй — 11% меди. Масса второго сплава больше массы первого на 4 кг. Из этих двух сплавов получили третий сплав, содержащий 10% меди. Найдите массу третьего сплава в кг.
Решение:
Составим уравнение, взяв за х массу первого сплава:
0,05х + 0,11(х + 4) = 0,1(2х + 4)
Дробные коэффициенты здесь – значения процентов, а выражения с х – массы сплавов.
Решим это уравнение.
0,05х + 0,11х + 0,44 = 0,2х + 0,4
0,04х = 0,04
Откуда х = 1.
Масса третьего сплава равна 2х+4 = 2 · 1 + 4 = 6.
Ответ: 6
Типы сплавов
Сплавы классифицируются как :
-
На основе принципа металла в сплаве : Примерами являются сплав меди, сплав железа, сплав свинца. Медный сплав содержит медь в качестве основного компонента, то есть бронзу.
-
На основе фаз : Могут быть однофазные сплавы (состоят из однородной поверхности) и двухфазные сплавы ( состоят из двух разных фаз). Примером однофазного сплава является латунь, содержащая 30% Zn + 70% Cu. Примером двухфазных сплавов является металл мюнца, содержащий 60% Cu + 40% Zn.
-
На основе содержания железа : На основе содержания железа сплавы классифицируются как сплавы черных и цветных металлов. Сплавы, содержащие Fe в качестве составной части, известны как сплавы черных металлов, в то время как сплавы цветных металлов не содержат Fe в качестве составной части. Примером черных сплавов является нержавеющая сталь, изготовленная из Fe + Cr. Примером цветных сплавов является припой, содержащий Pb + Sn.
Диаграмма плавкости сплавов
Иногда остановки в падении температуры наблюдаются и на кривой охлаждения твердого металла, указывая на какие-то связанные с выделением тепла процессы, происходящие уже в твердом веществе, например переход из одной аллотропической формы в другую.
Несколько иной вид имеет кривая охлаждения сплава двух металлов. Такая кривая изображена на рис. 136 справа.
Точка k, как и на первой кривой, отвечает началу затвердевания сплава, началу выделения кристаллов одного из входящих в сплав металлов.
При этом состав остающегося в жидком состоянии сплава изменяется и температура его затвердевания непрерывно понижается во время кристаллизации.
Однако выделяющееся при кристаллизации тепло все же замедляет ход охлаждения, вследствие чего в точке k происходит некоторый перелом кривой.
Выпадение кристаллов и равномерное понижение температуры происходят до тех пор, пока сплав не достигнет эвтектического состава.
Тогда падение температуры останавливается (точка k, так как выделение эвтектики идет при постоянной температуре.
Когда выделение эвтектики закончится, температура снова начинает падать по плавной кривой cb.
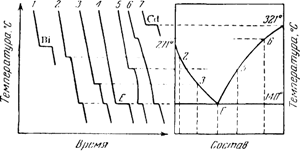
На основании ряда полученных таким образом кривых для различных сплавов двух металлов строится диаграмма плавкости данной системы.
Построение ее для системы Bi — Cd схематически показано на рис. 3.
Кривые 1 и 7 относятся к затвердеванию чистых металлов висмута и кадмия; все остальные кривые выражают остывание сплавов с постепенно уменьшающимся содержанием висмута.
Из них кривая 4 отвечает затвердеванию сплава эвтектического состава (60% Bi и 40% Cd). диаграммы плавкости, аналогичные рассмотренной нами, получаются только в простейших случаях, когда сплавляемые металлы не образуют ни химических соединений, ни твердого раствора.
Примером подобных сплавов, кроме описанного, могут служить сплавы: меди с серебром (эвтектика содержит 28% Сu и 72% Ag),свинца с сурьмой (эвтектика при 13% Sb и 87% Рb) и многие другие.
Сложные сплавы
Более сложный вид имеют диаграммы плавкости в тех случаях, когда два металла при сплавлении не просто растворяются друг в друге, но образуют одно или несколько химических соединений.
На рис. 4 изображена диаграмма плавкости системы магний — свинец, двух веществ, образующих определённое химическое соединение Mg2Pb. Здесь мы видим две эвтектические точки — В и D, отвечающие температурам 460 и 250°.
Выдающийся максимум на кривой ABCDE (точка С) соответствует температуре плавления Mg2Pb, а точка М на оси абсцисс указывает его состав.
По линии АВ из сплава при охлаждении выделяется магний, по линии ED— свинец и по линии BCD — Mg2Pb.
Так, если охлаждать жидкий сплав, содержащий, положим, 40% свинца (60% магния), то из него сперва будут выделяться кристаллы магния; по мере их выделения температура будет снижаться и когда она упадет до 460°.
Вся оставшаяся еще жидкой часть сплава начнет при постоянной температуре затвердевать, образуя эвтектическую смесь мельчайших кристалликов магния и химического соединения Mg2Pb.
Подобный же результат получится при охлаждении жидкого сплава, содержащего, например, 75% свинца, но в этом случае сначала будут выделяться кристаллы Mg2Pb.
Это будет происходить до тех пор, пока температура не снизится до 460° — точки образования эвтектики.
Аналогичные процессы с выделением эвтектики при 250° происходят при содержании в сплаве более 80% свинца (см. кривую CDE на рис. 4).
Таким образом, левая половина кривой от точки А до точки С представляет собой кривую плавкости сплавов магния и Mg2Pb, а правая — от точки С до точки Е — кривую плавкости сплавов свинца и Mg2Pb.
Эвтектика

Если два металла образуют при сплавлении несколько химических соединений, то на кривой плавкости получается такое же число максимумов, определяющих состав этих соединений.
Таким образом, термический анализ позволяет судить как о природе сплавов вообще, так и о числе и составе соединений, образуемых сплавляемыми металлами, от чего в конечном счете зависят все свойства сплавов.
Пример плавкости системы Bi — Cd
Пример. По диаграмме плавкости системы Bi — Cd определить:
- Какой металл будет выделяться в первую очередь при охлаждении жидкого сплава, содержащего 50% висмута и 50% кадмия;
- б) сколько граммов этого металла выделится из 500 г сплава до момента образования эвтектики.
1. Точка, отвечающая температуре, при которой начинается затвердевание сплава, должна лежать на кривой ВС выше точки С. Поэтому при охлаждении сплава в первую очередь будет выделяться кадмий до тех пор, пока состав остающейся жидкой части сплава не достигает эвтектики.
2. Так как эвтектика содержит 60% висмута, то, очевидно, весь висмут должен будет войти в состав эвтектики. Тогда вес входящего в эвтектику кадмия определится из пропорции
60 : 40 = 250 : x
откуда
x = (40 • 250) : 60 = 166,7 г. Cd
Следовательно, до момента образования эвтектики выделится
250 — 166,7 = 83,3 г Cd
Благодаря термическому анализу открыто существование огромного числа соединений одних металлов с другими, носящих общее название интерметаллических соединений.
Больше всего таких соединений, насколько пока известно, образуют щелочные и щелочноземельные металлы с металлами нечетных подгрупп, обладающими сравнительно слабыми металлическими свойствами.
Интерметаллические сплавы
Состав интерметаллических соединений обычно выражается формулами, совершенно несовместимыми с теми валентностями, которые металлы проявляют в соединениях с металлоидами.
Так, например, натрий образует с оловом и свинцом следующие ряды соединений:
NaSn6 NaSn4, NaSn3, NaSn2, NaSn, Na4Sn2, Na2Sn, Na3Sn, Na4Sn, NaPb, Na2Pb, Na4Pb
Многие интерметаллические соединения очень прочны и не разлагаются при температурах, лежащих значительно выше их точек плавления.
Интерметаллические соединения обладают способностью растворяться в жидком аммиаке, образуя проводящие ток растворы.
При электролизе таких растворов один из металлов, менее электроположительный, выделяется на аноде, другой— на катоде.
Например, при электролизе раствора Na4Pb9 на аноде выделяется свинец, а на катоде — натрий.
В растворах интерметаллические соединения могут вступать в реакции обмена с различными солями.
Например:
2Ca(NO3)2+ K4Pb =Ca2Pb + 4KNO3
Металлы могут вытесняться из интерметаллических соединений другими металлами совершенно так же, как из обыкновенных солей.
Образование интерметаллических соединений теоретически пока еще не объяснено. Установлено лишь, что очень близкие по химическим свойствам металлы обычно не образуют соединений друг с другом.
В последнее время при изучении сплавов широко применяются методы рентгеновского анализа, позволяющие устанавливать внутреннее строение кристаллов, образующих сплав, и определять их кристаллические решетки.
Свойства сплавов во многом отличаются от свойств сплавляемых металлов, отнюдь не являясь их средними арифметическими, ввиду образования при сплавлении различных химических соединений или твердых растворов.
Температура плавления сплавов очень часто бывает ниже температуры плавления наиболее легкоплавкой составной части сплава.
Примером сплава с очень низкой температурой плавления может служить сплав, состоящий из свинца (4 ч.), олова (2 ч.), висмута (6 ч.) и кадмия (1 ч.).
Он плавится около 75°, т. е. уже при опускании в горячую воду, между тем как температура плавления самого легкоплавкого из четырех названных металлов — олова — равна 231,9°.
Наоборот, твердость сплавов обычно больше твердости их составных частей, особенно если при сплавлении образуются химические соединения металлов, которые, как правило, тверже, чем сплавляемые металлы, но зато и более хрупки.
Очень большой твердостью обладают сплавы, содержащие твердые растворы.
Сплавы и Николай Семенович Курнаков
Многочисленные работы Курнакова по выяснению природы металлических сплавов внесли ясность в понимание процессов, происходящих при затвердевании сплавов.
В частности, при изучении сплавов им были открыты химические соединения, состав которых может изменяться в довольно широких пределах.
Эти соединения переменного состава Курнаков назвал бертоллидами по имени Бертолле, допускавшего их существование, предложив для обычных соединений постоянного состава название дальтониды.
Николай Семенович Курнаков родился 6 декабря (23 ноября) 1860 г. в г. Нолинске Вятской губ. Высшее образование получил в Петербургском горном институте, который окончил в 1882 г. В 1893 г. после защиты диссертации «О сложных металлических основаниях».
Курнаков был назначен профессором кафедры неорганической химии Горного института, а в 1913 г. занял кафедру общей химии а Петербургском политехническом институте, которой руководил до 1930 г.
В 1913 г. Курнаков был избран ординарным академиком.
В первый период своей научной деятельности Курнаков занимался изучением строения и свойств комплексных соединений.
На эту тему написана и его докторская диссертация. Главные же исследования Курнакова посвящены металлическим сплавам, к изучению которых он применил термический анализ и другие приемы созданного им физико-химического анализа, а также металлографию.
Эти исследования вскрыли ряд весьма важных закономерностей, объясняющих поведение металлов при сплавлении и позволяющих заранее предсказать физико-химические и механические свойства сплавов.
Работы Курнакова имели не только теоретическое, но и огромное практическое значение.
Наряду с исследованиями сплавов Курнаков уделял много времени и внимания изучению природных соляных растворов.
Его работы в этой области позволили разрешить ряд важнейших проблем в использовании отечественных соляных ресурсов и привели к открытию крупнейших в мире месторождений калийных солей в Соликамском районе.

Из различных видов физико-химического анализа при изучении сплавов чаще всего применяется термический анализ, начало которому было положено в 60-х годах прошлого столетия русским металлургом Д. К. Черновым.
Термический анализ заключается в построении и изучении диаграмм плавкости, которые выражают зависимость температур плавления сплавов от процентного содержания составных частей.
Чтобы иметь представление о термическом анализе, рассмотрим несколько примеров.
Чтобы иметь представление о термическом анализе, рассмотрим несколько примеров.
Примеры термического анализа сплавов
При охлаждении жидкого сплава, содержащего, положим, 20% кадмия и 80% висмута, из него при некоторой температуре, соответствующей точке К, начнет выкристаллизовываться чистый висмут, так что остающийся жидкий сплав будет становиться беднее этим веществом.
По мере выделения кристаллов висмута температура будет падать, и когда достигнет точки С (140°), весь остававшийся жидким сплав начнет затвердевать, как одно целое, при постоянной температуре.
Аналогичная картина получится, если охлаждать сплав, содержащий 60% Cd и 40% Bi, только теперь вначале будет выделяться кадмий .
Температура 140°, представляющая собой самую низкую температуру плавления, какую только может иметь сплав висмута с кадмием, называется эвтектической температурой.
А сплав, отвечающий по составу этой точке, — эвтектической смесью или просто эвтектикой. В данном случае эвтектика содержит 40% кадмия и 60% висмута.
Пока сплав содержит меньше 40% кадмия, при охлаждении сплава выделяется висмут, играющий, таким образом, роль растворителя, кадмий же является растворенным веществом. В точке С роли висмута и кадмия меняются.
Из сплавов, содержащих более 40% кадмия, сперва выкристаллизовывается кадмий, теперь кадмий — растворитель, а висмут — растворенное вещество.
И только в том случае, когда содержание кадмия в сплаве составляет 40%, оба металла начинают кристаллизоваться одновременно, образуя эвтектику» При исследования эвтектики под микроскопом она оказывается состоящей из мельчайших кристалликов висмута и кадмия, тесно к перемешанных друг с другом .

Сплавы висмута с кадмием иного состава содержат крупные; кристаллы одного из металлов, вкрапленные в сплошную массу эвтектики.
Диаграммы плавкости строят обычно, исходя из кривых охлаждения сплавов. Для получения этих кривых берут два чистых металла и приготовляют из них ряд смесей различного состава.
Каждую из приготовленных смесей расплавляют и затем медленно охлаждают, отмечая через точно определенные промежутки времени температуру остывающего сплава.
По данным наблюдений строят кривые охлаждения, откладывая на оси абсцисс время, а на оси ординат — температуру.
Для таких исследовании, составляющих содержание специальной научной дисциплины — металлографии, небольшой участок сплава шлифуют и полируют, пока не получится блестящая зеркальная поверхность.
Отполированную поверхность травят раствором какой-нибудь кислоты, щелочи или другого реактива Одни вещества сильнее разъедаются реактивом, другие меньше, и на отполированной поверхности выступают очертания составных частей сплава.
Полученный шлиф изучается под микроскопом в отраженном свете. На рис. 2 показан шлиф эвтектического сплава олова и свинца.
Основы металлографии были заложены более 100 лет назад русским инженером П. П.Аносовым, впервые начавшим применять описанный метод исследования на уральских Златоустовский заводах.
Часто задаваемые вопросы ответы о сплавах?
Что такое сплавы?
Сплавы – это смеси двух или более элементов, среди которых преобладают металлы. Металлы, входящие в сплав, называют основой.
Часто в сплав добавляют элементы неметаллы, придающие сплавам особые свойства, их называют легирующими или модифицирующими добавками.
Какие элементы состоят из сплавов?
Сплавы состоят из основы (одного или нескольких металлов), малых добавок специально вводимых в сплав легирующих и модифицирующих элементов, а также из неудалённых примесей (природных, технологических и случайных).
Какие свойства имеют сплавы?
Свойства сплавов зависят от их структуры. Для сплавов характерны структурно-нечувствительные (определяются природой и концентрацией элементов, составляющих сплавы) и структурно-чувствительные свойства (зависят от характеристик основы).
Какие свойства характерные для сплавов?
Также все свойства, характерные для сплавов можно разделить на химические (отношение сплавов к воздействию активных сред – вода, воздух, кислоты и т.д.) и механические (отношение сплавов к воздействию внешних сил).
Статья на тему Сплавы

