Теория:
Валентность лития (Li) равна I (один).
Это означает, что атом лития всегда образует одну химическую связь с другими атомами в соединениях.
Литий является щелочным металлом и находится в первой группе Периодической таблицы, имея один электрон на внешнем энергетическом уровне, который он легко отдает, образуя ион Li+.
Это постоянная валентность для него, то есть во всех своих соединениях он проявляет одну и ту же валентность.

Объяснение почему валентность лития равна I на атомном уровне
Чтобы понять, почему валентность лития равна I, нужно знать строение его атома:
✅Порядковый номер: Литий имеет порядковый номер 3 в Периодической таблице Д.И. Менделеева.
Это означает, что его ядро содержит 3 протона, а нейтральный атом — 3 электрона.
✅Электронная конфигурация: Электроны атома лития располагаются по энергетическим уровням следующим образом:
Первый энергетический уровень (ближайший к ядру): 2 электрона (полностью заполнен).
Второй энергетический уровень (внешний): 1 электрон.
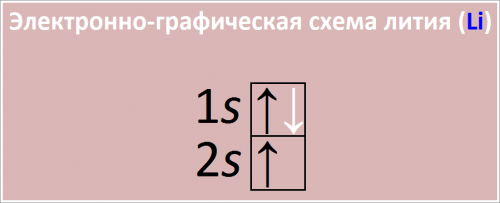
Электронная конфигурация лития: 1s22s1.
✅Стремление к стабильности (правило октета/дублета): Атомы стремятся приобрести стабильную электронную конфигурацию внешнего энергетического уровня, подобную конфигурации благородных газов (имеющих 8 электронов на внешнем уровне, или 2 для первого уровня — т.н. дублет).
Для лития гораздо легче отдать один электрон с внешнего (второго) уровня, чем принять семь электронов для его заполнения.
При потере одного электрона атом лития превращается в положительно заряженный ион лития (Li+).
Его электронная конфигурация становится 1s2, что соответствует стабильной конфигурации атома гелия (He), ближайшего благородного газа.
Именно способность атома лития отдавать один электрон для достижения стабильности определяет его валентность как I (один).
Интересный факт: несмотря на то что литий, как и все щелочные металлы (группа I), имеет всего один валентный электрон, который он легко отдает, он является наименее реакционноспособным из всех щелочных металлов.
Какую связь образует литий
Будучи активным металлом, склонен отдавать свои валентные электроны. Поэтому он преимущественно образует ионные связи с неметаллами, которые, напротив, стремятся принять электроны.
Ионная связь — это тип химической связи, которая образуется за счет полного перехода электронов от атома одного элемента (металла) к атому другого элемента (неметалла).
В результате чего образуются противоположно заряженные ионы.
Эти ионы затем притягиваются друг к другу за счет электростатических сил.
Примеры соединений лития с валентностью I
В каждом из этих соединений литий отдает один электрон:
Оксид лития (Li2O): Два атома лития (каждый с валентностью I) отдают по одному электрону атому кислорода (который принимает 2 электрона, проявляя валентность II).
Хлорид лития (LiCl): Атом лития (валентность I) отдает один электрон атому хлора (который принимает 1 электрон, проявляя валентность I).
Фторид лития (LiF): Атом лития (валентность I) отдает один электрон атому фтора (который принимает 1 электрон, проявляя валентность I).
Гидрид лития (LiH): Атом лития (валентность I) отдает один электрон атому водорода (в данном случае водород выступает как неметалл, принимая электрон и образуя гидрид-ион H—).
Визуализация
1. Атомная структура лития:
Представьте себе схему атома лития:
В центре — ядро (красные шарики для протонов, синие для нейтронов).
Вокруг ядра — две электронные оболочки (энергетических уровня):
Ближайшая к ядру оболочка (первый уровень) имеет два электрона.
Внешняя оболочка (второй уровень) имеет один электрон. Это схематически изображает его электронную конфигурацию 1s22s1.
(Для примера, схема электронной конфигурации атома лития может выглядеть так:)
Пример решения, задача:
Определите, сколько атомов лития потребуется для образования соединения с одним атомом серы, если известно, что сера в данном соединении проявляет валентность II.
Напишите формулу образовавшегося соединения.
Решение:
Определение валентности лития:
Как мы знаем, валентность лития (Li) всегда равна I.
Определение валентности серы:
В условии задачи указано, что сера (S) в данном соединении проявляет валентность II.
Составление формулы соединения по валентности:
Для составления химической формулы по валентности используется принцип «крест-накрест» или наименьшего общего кратного.
Цель — чтобы общее количество «единиц валентности», предоставленных одним элементом, было равно общему количеству «единиц валентности», принятых другим элементом.
Валентность Li: I
Валентность S: II
Чтобы общее количество валентных связей было уравновешено, нам нужно:
2 «единицы валентности» от серы (валентность II).
Для этого потребуется 2 атома лития, каждый из которых предоставляет 1 «единицу валентности» (1 + 1 = 2).
Таким образом, на один атом серы потребуется два атома лития.
Написание формулы соединения:
Соединение, образованное двумя атомами лития и одним атомом серы, имеет формулу: Li2S.
Это соединение называется сульфидом лития.
Ответ:
Для образования соединения с одним атомом серы (валентность II) потребуется два атома лития. Формула образовавшегося соединения — Li2S.
Часто задаваемые вопросы:
Валентность лития (Li) всегда равна I (один).
Это значит, что атом лития всегда образует одну химическую связь с другими атомами в соединениях.
Атом имеет один неспаренный s-электрон, поэтому его валентность при нормальных условиях равна — 1.
Положение в Периодической таблице: Литий (Li) находится в I группе (первой колонке) главной подгруппы.
Номер группы для элементов главных подгрупп указывает на количество валентных электронов.
Электронная конфигурация: Порядковый номер лития — 3. Его электроны расположены:
2 на первом уровне и 1 на втором (внешнем) уровне. Электронная конфигурация: 1s22s1.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.