Теория:
Валентность бериллия (Be) — это способность образовывать в соединениях две химические связи, то есть II (два).
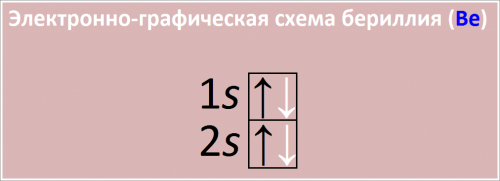
У него 4 электрона, из них 2 валентных электрона находятся на внешнем энергетическом уровне (1s22s2).
Для достижения стабильной конфигурации, как у гелия, бериллий стремится отдать (или обобществить) эти два электрона.
Важно отметить, что, несмотря на то что бериллий металл, из-за своего малого размера и высокой энергии ионизации он преимущественно образует ковалентные связи, а не ионные, как большинство щелочноземельных металлов.

Какова валентность бериллия? (и схожие: валентность бериллия).
Валентность бериллия (Be) равна II (два). Это постоянная валентность для бериллия; во всех своих соединениях он проявляет валентность II (степень окисления +2).
Чтобы понять, почему валентность бериллия равна II, рассмотрим его атомное строение:
Порядковый номер: Бериллий имеет порядковый номер 4 в Периодической таблице. Это означает, что его ядро содержит 4 протона, а нейтральный атом — 4 электрона.
Электронная конфигурация: Электроны атома бериллия располагаются следующим образом:
Первый энергетический уровень (внутренний): 2 электрона (полностью заполнен).
Второй энергетический уровень (внешний): 2 электрона.
Электронная конфигурация бериллия: 1s22s2.
Стремление к стабильности: Атомы стремятся достичь стабильной электронной конфигурации, похожей на конфигурацию благородных газов.
Для бериллия это означает стремление к конфигурации гелия (He, 1s2), которая достигается путем отдачи двух электронов с внешнего энергетического уровня.
Образование иона/связей: При потере двух электронов атом бериллия превращается в положительно заряженный ион бериллия (Be2+).
Именно способность отдавать эти два электрона (или образовывать две общие электронные пары) определяет его валентность как II.
Какую связь образует бериллий? Тип связи
Бериллий, являясь металлом, тем не менее, образует преимущественно ковалентные связи, а не типично ионные, как большинство щелочноземельных металлов (например, кальций или барий).
Это происходит из за того, что атом бериллия очень мал, а его ион Be2+ имеет относительно высокий заряд при таком малом радиусе.
Это приводит к высокой поляризующей способности иона Be2+
— он сильно притягивает к себе электронные облака соседних атомов.
Высокие энергии ионизации: Для металла у бериллия относительно высокие энергии ионизации (особенно вторая энергия ионизации).
Полный отрыв двух электронов требует значительных затрат энергии.
Из-за этих факторов бериллий предпочитает образовывать общие электронные пары с другими атомами, а не полностью отдавать электроны.
Ковалентная связь — это тип химической связи, при которой атомы достигают стабильности, обобществляя (деля) одну или несколько электронных пар.
Примеры соединений
В большинстве своих соединений бериллий проявляет валентность II.
Оксид бериллия (BeO): Бериллий образует две ковалентные связи с кислородом.
Хлорид бериллия (BeCl2): Каждый атом бериллия образует две ковалентные связи с двумя атомами хлора.
Молекула имеет линейное строение.
Фторид бериллия (BeF2): Аналогично хлориду, бериллий связан с двумя атомами фтора ковалентными связями.
Гидроксид бериллия (Be(OH)2): Бериллий связан с двумя гидроксильными группами.
Сульфат бериллия (BeSO4): Бериллий связан с сульфат-ионом.
Визуализация
Атомная структура бериллия:
Представьте схему атома бериллия:
В центре — ядро (с 4 протонами).
Две электронные оболочки (энергетических уровня):
Первая оболочка (внутренняя): 2 электрона.
Вторая оболочка (внешняя): 2 электрона.
(Для примера, схема электронной конфигурации атома бериллия может выглядеть аналогично литию, но с двумя электронами на внешней оболочке: (примерно), где на внешней оболочке 2 точки/электрона).
Образование ковалентной связи
Образование ковалентной связи (на примере хлорида бериллия, BeCl2):
Представьте схему, где:
В центре — атом бериллия (Be).
Слева и справа от него — по атому хлора (Cl).
Между атомом бериллия и каждым атомом хлора показаны общие электронные пары (как правило, с помощью точек или черточек), символизирующие ковалентную связь.
Например, Cl — Be — Cl, где каждая черточка — это общая пара электронов.
Каждый атом хлора также имеет свои несвязывающие (неподелённые) электронные пары.
Валентность бериллия в соединениях всегда равна II, но из-за его специфических атомных свойств, он чаще образует ковалентные, а не ионные связи, что отличает его от других металлов второй группы.
Пример решения, задача:
Определите, сколько атомов бериллия потребуется для образования соединения с одним атомом кислорода.
Напишите формулу образовавшегося соединения и назовите его.
✅Определение валентности бериллия:
Валентность бериллия (Be) всегда равна II (два).
Определение валентности кислорода:
Кислород (O) в большинстве своих соединений также проявляет валентность II (два).
Составление формулы соединения по валентности:
Для составления химической формулы по валентности необходимо найти наименьшее общее кратное (НОК) для валентностей взаимодействующих элементов.
Валентность Be: II
Валентность O: II
Наименьшее общее кратное для 2 и 2 равно 2.
Чтобы обеспечить «баланс» валентностей:
Количество атомов бериллия = НОК / Валентность Be = 2 / 2 = 1
Количество атомов кислорода = НОК / Валентность O = 2 / 2 = 1
Таким образом, для образования соединения потребуется один атом бериллия и один атом кислорода.
Написание формулы соединения:
Соединение, образованное одним атомом бериллия и одним атомом кислорода, имеет формулу: BeO.
Название соединения:
Это соединение называется оксидом бериллия.
✅Ответ:
Для образования соединения с одним атомом кислорода потребуется один атом бериллия.
Формула образовавшегося соединения — BeO, которое называется оксидом бериллия.
Часто задаваемые вопросы:
У бериллия одна валентность — II (два), потому что у атома бериллия на внешнем энергетическом уровне всегда находится ровно 2 валентных электрона.
Для достижения стабильного состояния он либо отдает эти 2 электрона, либо образует 2 общие электронные пары с другими атомами. Это и определяет его постоянную валентность II.
У бериллия 2 валентных электрона.
Можно использовать два основных подхода:
1. Положение в Периодической таблице.
2. Электронная конфигурация.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.