Теория:
Свинец (Pb) в периодической системе: 6‑й период, 14‑я группа (по устаревшей классификации — IVA), атомная масса 207.2 а.е.м.
Занимает положение в 6‑м периоде, что определяет его принадлежность к группе тяжелых металлов.
В отличие от радиоактивных трансуранов, свинец является стабильным элементом, завершающим многие цепочки радиоактивного распада.
Будучи химическим гомологом (аналогом) олова, он проявляет свойства типичного амфотерного металла.
Его поведение в соединениях продиктовано наличием четырех валентных электронов на внешнем p-подуровне.
А его нахождение в 14‑й группе (ранее — главная подгруппа IV группы) задает ключевые параметры: наиболее характерные степени окисления +2 и +4.
При этом состояние +2 для свинца является более стабильным из-за эффекта инертной электронной пары.
Структура атома подтверждается его электронной формулой (конфигурацией):
[Xe] 4f14 5d10 6s2 6p2.
На которой наглядно можно определить его положение как представителя p-блока, находящегося после таллия и перед висмутом.
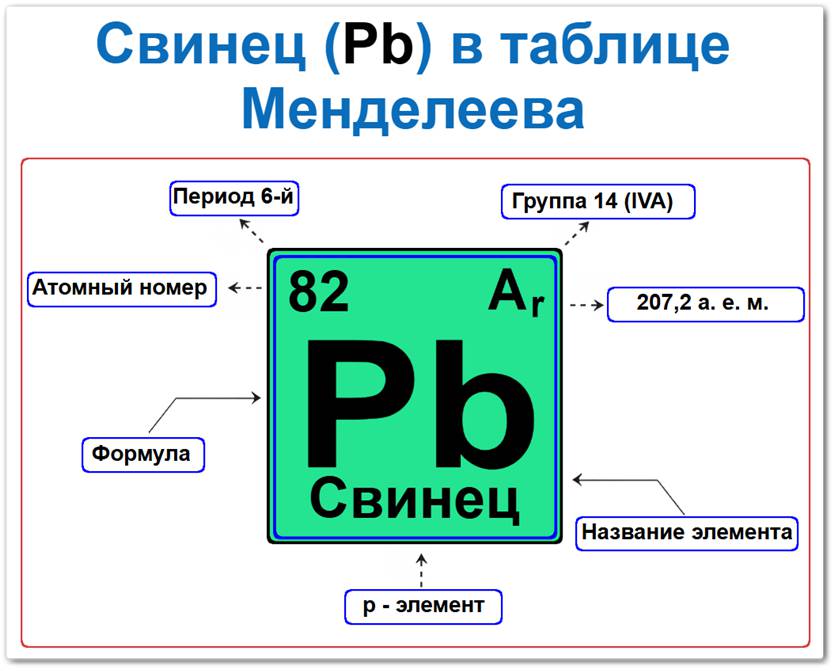
Свинец в таблице Менделеева можно определить на основании закона периодичности: положение в группе и периоде, а также порядкового номера / атомный номер (Z = 82).
Как определить положение Свинца в Таблице Менделеева
Локация свинца в таблице описывается характеристиками его стабильного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (вертикальный ряд углерода).
- Период (горизонтальный ряд).
- Электронное семейство (свинец — p‑элемент).
Порядковый номер / атомный номер (Z = 82)
- Служит уникальным кодом элемента, завершающего группу стабильных тяжелых ядер.
- В ядре — 82 протона (магическое число, обеспечивающее высокую стабильность); в нейтральной оболочке — 82 электрона.
- Электронное строение: [Xe] 4f14 5d10 6s2 6p2.
Важно: Номер 82 делает свинец одним из самых тяжелых элементов, имеющих стабильные изотопы, что широко используется в защите от радиации.
Название и символ
- Название: «свинец» (латинское Plumbum, откуда пошло название «плюмбум»).
- Символ: Pb.
- Примечание: Известен человечеству с глубокой древности благодаря легкоплавкости и распространенности в природе.
Группа (14 / IV A)
Расположен в 14‑й группе (подгруппа углерода), являясь самым тяжелым стабильным металлом в этой колонке.
Химический потенциал:
- Валентность свинца: проявляет валентность II и IV.
- Степень окисления: +2 (наиболее устойчивая) и +4 (сильный окислитель).
- Амфотерность: свинец способен растворяться как в кислотах, так и в щелочах.
Период (6‑й)
Находится в 6‑м периоде — его электроны распределены по шести энергетическим уровням.
Влияние на свойства:
- Плотность: Большая атомная масса и компактная решетка обеспечивают высокую плотность (11.34 г/см³).
- Защитные свойства: Благодаря большому числу электронов (82), атомы свинца эффективно поглощают рентгеновское и гамма-излучение.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(Pb) ≈ 207.2 а.е.м.
- Определение: средневзвешенная масса четырех стабильных природных изотопов.
- Стабильность: Свинец — «финишная прямая» радиоактивности; изотоп 206Pb является конечным продуктом распада урана.
Все значения для всех элементов можно узнать в таблице атомных масс.
p‑Элемент (электронное семейство)
Застраивающимся является внешний 6p‑подуровнь (6p2).
Специфика блока: В отличие от d-металлов, свинец более мягкий, легкоплавкий и обладает выраженными свойствами металлов главных подгрупп.
Определение энергетических уровней Свинца по Таблице Менделеева
Положение Свинца (Pb) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 6-й период (Количество этажей)
Свинец находится в шестой строке таблицы. Номер периода определяет число электронных слоев.
- Итог: У Свинца 6 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Свинца — 82. Его 82 электрона распределены по уровням следующим образом:
Pb ) 2 ) 8 ) 18 ) 32 ) 18 ) 4
Для сравнения: У соседа слева, Таллия (81), на внешнем уровне 3 электрона, а у Свинца (82) — 4.
3. 14-я группа (Химический характер)
Свинец возглавляет металлическую часть 14-й группы.
- p-элемент: Его основные химические свойства определяются парой 6p-электронов.
- Место в блоке: Он является «тяжелым аналогом» олова и германия.
Проверка знаний: Как определить свинец по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Свинец (Pb) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 82. Точное число протонов в ядре свинца.
- 2) 6-й период, 14-я группа. Точные координаты элемента.
- 3) Аналог олова. Оба элемента находятся в одной группе и имеют схожее строение внешних оболочек.
- 4) Ошибка. Свинец — один из самых тяжелых металлов, а не газ.
- 5) Ошибка. Свинец находится в правой части таблицы (p-блок).
- 6) Ошибка. Как элемент 6-го периода, он имеет 6 слоев.
Часто задаваемые вопросы:
Расположен в 6-м периоде, 14-й группе (главная подгруппа IV группы). Его атомный номер — 82.
У свинца 6 энергетических уровней, так как он находится в 6-м периоде. Распределение: 2, 8, 18, 32, 18, 4.
Относительная атомная масса свинца составляет 207.2 а.е.м. (усредненное значение природных изотопов).