Теория:
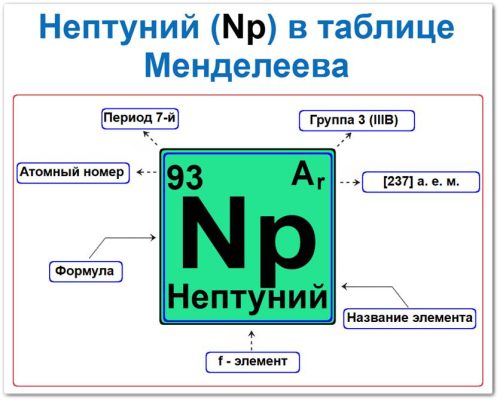
Нептуний (Np) в периодической системе: 7‑й период, 3‑я группа (по устаревшей классификации — IIIB), атомная масса [237] (массовое число наиболее устойчивого изотопа).
Занимает положение в 7‑м периоде, что определяет его принадлежность к началу ряда трансурановых элементов — актиноидов.
Будучи химическим гомологом (аналогом) лантаноида прометия, он проявляет свойства активного радиоактивного металла.
Его поведение и многообразие степеней окисления в растворах продиктовано началом заполнения 5f-подуровня.
А его нахождение в 3‑й группе (семейство актиноидов) задает ключевые параметры:
- Базовую валентность III.
- Проявляет степени окисления до +7, что сближает его по свойствам с переходными металлами d-блока.
Структура атома подтверждается его электронной формулой (конфигурацией):
[Rn] 5f4 6d1 7s2.
На которой наглядно можно определить его положение как представителя f-блока, находящегося сразу за ураном и перед плутонием.
Нептуний в таблице Менделеева можно определить на основании закона периодичности: положение в группе и периоде, а также порядкового номера / атомный номер (Z = 93)
Как определить положение Нептуния в Таблице Менделеева
Локация нептуния в таблице описывается характеристиками его радиоактивного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (вертикальный ряд актиноидов).
- Период (горизонтальный ряд).
- Электронное семейство (нептуний — f‑элемент).
Порядковый номер / атомный номер (Z = 93)
- Служит уникальным кодом элемента как первого искусственного элемента за пределами природного урана.
- В ядре — 93 протона; в нейтральной оболочке — 93 электронов.
- Электронное строение: [Rn] 5f4 6d1 7s2.
Важно: Нептуний стал «первенцем» среди трансуранов, доказав, что человек может расширять таблицу Менделеева искусственным путем.
Название и символ
- Название: «нептуний» (назван в честь планеты Нептун, следующей за Ураном в Солнечной системе).
- Символ: Np.
- Примечание: Элемент был получен в 1940 году Эдвином Макмилланом и Филиппом Эйбельсоном в Беркли.
Группа (3 / III B)
Расположен в 3‑й группе (в ряду актиноидов). Из-за того, что 5f-электроны в начале ряда еще слабо удерживаются, Нептуний проявляет гораздо больше химических сходств с вольфрамом или марганцем, чем его более тяжелые собратья.
Химический потенциал:
- Валентность нептуния: проявляет переменные валентности от III до VII.
- Степень окисления: наиболее устойчива в растворах +5, но известны стабильные соединения в состояниях +4 и +6.
Период (7‑й)
Находится в 7‑м периоде — его электроны распределены по семи энергетическим уровням.
Влияние на свойства:
- Металлический блеск: В чистом виде это серебристый, довольно тяжелый и плотный металл.
- Радиоактивность: Нептуний-237 является долгоживущим альфа-излучателем, что требует особых условий защиты при работе с ним.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(Np) ≈ [237] а.е.м. (для изотопа 237Np).
- Определение: атомная масса самого стабильного нуклида, присутствующего в ядерных отходах.
- Стабильность: Изотоп 237Np имеет внушительный период полураспада — 2,14 миллиона лет, что делает его практически «стабильным» для химических опытов.
Все значения для всех элементов можно узнать в таблице атомных масс.
f‑Элемент (электронное семейство)
Относится к f‑семейству, так как идет заполнение 5f‑подуровня.
Специфика блока: У Нептуния электроны 5f и 6d слоев близки по энергии, поэтому он может задействовать их в химических связях одновременно, демонстрируя высокую химическую активность.
Определение энергетических уровней Нептуния по Таблице Менделеева
Положение Нептуния (Np) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 7-й период (Количество этажей)
Нептуний находится в седьмой строке таблицы. Номер периода совпадает с общим числом электронных слоев.
- Итог: У Нептуния 7 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Нептуния — 93. Его 93 электрона распределены по уровням следующим образом:
Np ) 2 ) 8 ) 18 ) 32 ) 22 ) 9 ) 2
Для сравнения: У соседа слева, Урана (92), на пятом уровне 21 электрон, а у Нептуния (93) — 22.
3. 3-я группа (Химический характер)
Нептуний входит в семейство актиноидов.
- f-элемент: Его фундамент — 5f-оболочка.
- Место в блоке: Он является «тяжелым аналогом» прометия (Pm), но обладает гораздо более богатой химией из-за близости уровней 5f и 6d.
Проверка знаний: Как определить нептуний по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Нептуний (Np) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 93. Это место Нептуния сразу после урана.
- 2) Актиноид 7-го периода. Стандартное положение f-элементов данной группы.
- 3) Назван в честь планеты. Логика названий: Уран (92) -> Нептун (93) -> Плутон (94).
- 4) Ошибка. Нептуний — это тяжелый металл.
- 5) Ошибка. Он находится в самом низу таблицы (7 период).
- 6) Ошибка. Его атомная масса (237) в сотни раз больше массы водорода.
Часто задаваемые вопросы:
Он расположен в 7-м периоде, 3-й группе. Является актиноидом с атомным номером 93.
У него 7 энергетических уровней, так как он находится в 7-м периоде. Электронная схема: 2, 8, 18, 32, 22, 9, 2.
Приблизительно [237] а.е.м. (по наиболее долгоживущему изотопу 237Np).

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.