Теория:
Висмут (Bi) занимает положение в 6‑м периоде, что определяет его принадлежность к ряду тяжелых металлов p-блока.
Он является последним элементом в таблице, который долгое время считался абсолютно стабильным.
Будучи химическим гомологом (аналогом) сурьмы и мышьяка, он проявляет свойства типичного постпереходного металла.
Его поведение в сплавах и химических соединениях продиктовано завершением заполнения 6p-подуровня.
А его нахождение в 15‑й группе (ранее — главная подгруппа V группы) задает ключевые параметры:
- Наиболее характерные валентности III и V.
- А также специфический диамагнетизм — висмут сильнее любого другого металла выталкивается магнитным полем.
Структура атома подтверждается его электронной формулой (конфигурацией):
[Xe] 4f14 5d10 6s2 6p3.
На которой наглядно можно определить его положение как представителя p-блока, находящегося за свинцом и перед радиоактивным полонием.
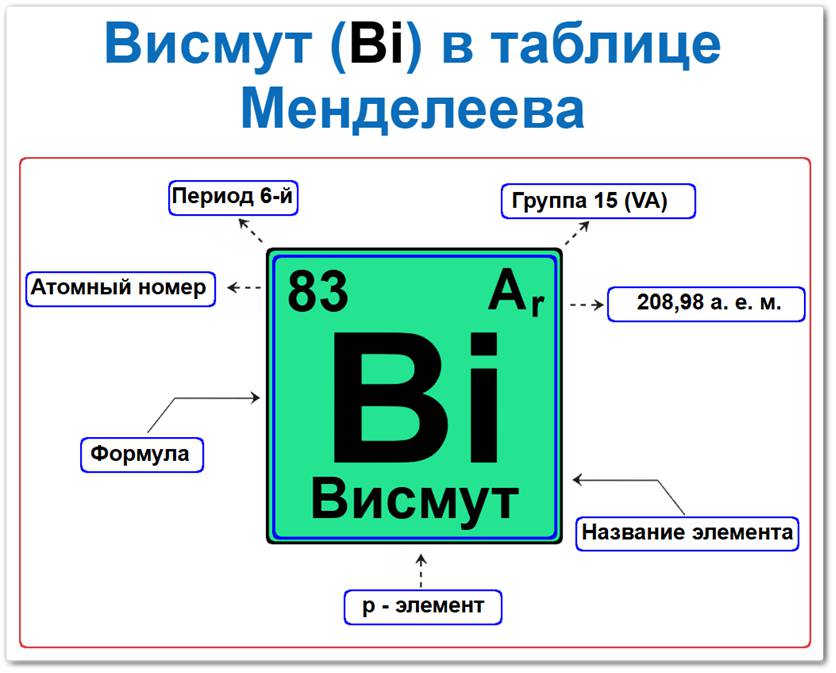
Висмут в таблице Менделеева можно определить на основании закона периодичности: положение в группе и периоде, а также порядкового номера / атомный номер (Z = 83).
Как определить положение Висмута в Таблице Менделеева
Локация висмута в таблице описывается характеристиками его массивного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (вертикальный ряд пниктогенов).
- Период (горизонтальный ряд).
- Электронное семейство (висмут — p‑элемент).
Порядковый номер / атомный номер (Z = 83)
- Служит уникальным кодом элемента, завершающим ряд практически стабильных тяжелых металлов.
- В ядре — 83 протона; в нейтральной оболочке — 83 электрона.
- Электронное строение: [Xe] 4f14 5d10 6s2 6p3.
Важно: Наличие 3 электронов на 6p-подуровне определяет его принадлежность к группе азота и склонность к образованию соединений в степенях окисления +3 и +5.
Название и символ
- Название: «висмут» (происходит от нем. weisse Masse — «белая масса»).
- Символ: Bi.
- Примечание: Висмут известен с глубокой древности, хотя его часто путали со свинцом и оловом до середины XVIII века.
Группа (15 / V A)
Расположен в 15‑й группе (подгруппа азота), которая объединяет элементы с пятью валентными электронами.
Химический потенциал:
- Валентность висмута: доминирующая валентность III и V.
- Степень окисления: наиболее стабильна +3. В отличие от легких аналогов (азота, фосфора), висмут проявляет ярко выраженные металлические свойства.
Период (6‑й)
Находится в 6‑м периоде — его электроны распределены по шести энергетическим уровням.
Влияние на свойства:
- Эффект инертной пары: Из-за большой глубины 6s-орбиталей висмуту сложнее проявлять высшую степень окисления +5, чем его предшественникам по группе.
- Диамагнетизм: Шестой период и тяжелое ядро делают висмут рекордсменом по диагмагнитным свойствам среди металлов.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(Bi) ≈ 208.98 а.е.м.
- Определение: средняя масса природного изотопа 209Bi.
- Стабильность: До 2003 года висмут считался самым тяжелым стабильным элементом. Сейчас доказано, что он слабо радиоактивен (период полураспада в миллиарды раз больше возраста Вселенной).
Все значения для всех элементов можно узнать в таблице атомных масс.
p‑Элемент (электронное семейство)
Застраивающимся является внешний 6p‑подуровень (6p3).
Специфика блока: Как типичный p-металл, висмут имеет низкую температуру плавления и является плохим проводником тепла и электричества по сравнению с d-металлами.
Определение энергетических уровней Висмута по Таблице Менделеева
Положение Висмута (Bi) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 6-й период (Количество этажей)
Висмут находится в шестой строке таблицы. Номер периода определяет число электронных слоев.
- Итог: У Висмута 6 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Висмута — 83. Его 83 электрона распределены по уровням следующим образом:
Bi ) 2 ) 8 ) 18 ) 32 ) 18 ) 5
Для сравнения: У соседа слева, Свинца (82), на внешнем уровне 4 электрона, а у Висмута (83) — 5.
3. 15-я группа (Химический характер)
Висмут входит в подгруппу пниктогенов.
- p-элемент: Его химический облик определяется тремя неспаренными электронами на p-оболочке.
- Место в блоке: В отличие от неметалла азота и полуметалла сурьмы, висмут является полноценным, хотя и хрупким, металлом.
Проверка знаний: Как определить висмут по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Висмут (Bi) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 83. Главная координата висмута в системе.
- 2) 15-я группа, 6-й период. Точный адрес элемента в таблице.
- 3) p-элемент. Это определяет его химические свойства и положение в правой части таблицы.
- 4) Ошибка. Висмут — металл, он не горит как топливо.
- 5) Ошибка. Висмут в 15-й группе, а щелочные металлы — в 1-й.
- 6) Ошибка. Висмут — очень тяжелый и плотный металл.
Часто задаваемые вопросы:
Расположен в 6-м периоде, 15-й группе (подгруппа азота). Его атомный номер — 83.
Так как он находится в 6-м периоде, у него 6 энергетических уровней.
Распределение электронов: 2, 8, 18, 32, 18, 5.
Технически — да, но его период полураспада настолько огромен (1,9·1019 лет), что в любых практических и химических смыслах он считается стабильным.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.