Теория:
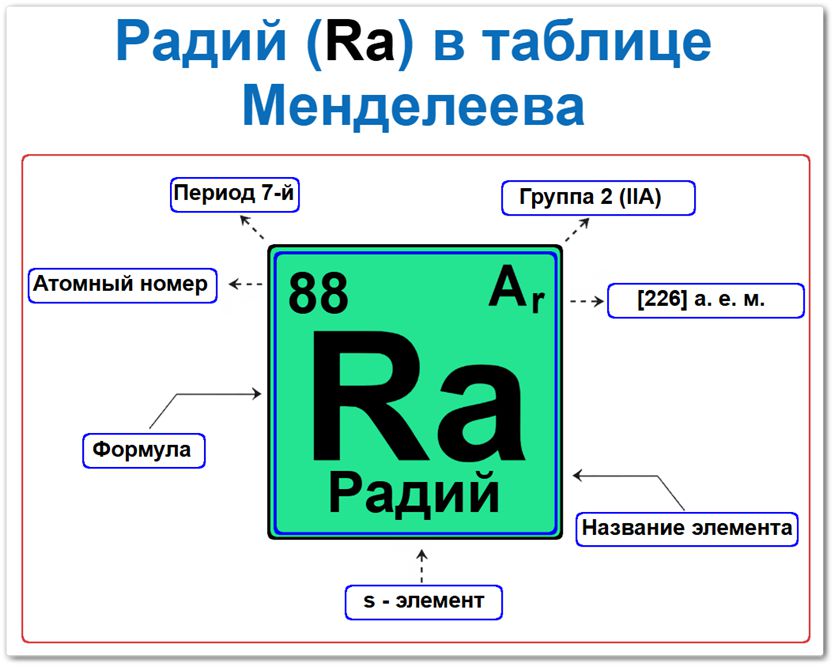
Радий (Ra) в периодической системе: 7‑й период, 2‑я группа (по устаревшей классификации — IIА), атомная масса [226] а.е.м.
занимает положение в 7‑м периоде, что определяет его статус самого тяжелого природного щелочноземельного металла.
Будучи химическим гомологом (аналогом) бария, он проявляет свойства типичного активного металла.
Его поведение в химических реакциях продиктовано наличием двух валентных электронов на внешнем 7s-подуровне, что делает его крайне реакционноспособным.
А его нахождение во 2‑й группе (главная подгруппа II группы) задает ключевые параметры:
- Постоянную валентность II.
- Единственно стабильную степень окисления +2, характерную для всех «собратьев» по группе — от бериллия до бария.
Структура атома подтверждается его электронной формулой (конфигурацией):
[Rn] 7s2.
На которой наглядно можно определить его положение как завершающего s-элемента седьмого ряда, находящегося за Францием и перед Актинием.
Радий в таблице Менделеева можно определить на основании закона периодичности: положение в группе и периоде, а также порядкового номера / атомный номер (Z = 88).
Как определить положение Радия в Таблице Менделеева
Локация радия в таблице описывается характеристиками его радиоактивного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (вертикальный ряд щелочноземельных металлов).
- Период (горизонтальный ряд).
- Электронное семейство (радий — s‑элемент).
Порядковый номер / атомный номер (Z = 88)
- Служит уникальным кодом элемента в ряду естественных радиоактивных металлов.
- В ядре — 88 протонов; в нейтральной оболочке — 88 электронов.
- Электронное строение: [Rn] 7s2.
Важно: Наличие 2 электронов на внешнем уровне роднит его с кальцием и барием, обеспечивая схожесть химических реакций, но с гораздо более высокой активностью.
Название и символ
- Название: «радий» (от латинского radius — «луч», из-за его мощного излучения).
- Символ: Ra.
- Примечание: Элемент был открыт Пьером и Марией Кюри в 1898 году, которые выделили его из урановой смолки.
Группа (2 / II A)
Расположен во 2‑й группе (главной подгруппе II группы), где находятся щелочноземельные металлы.
Химический потенциал:
- Валентность радия: строго II.
- Степень окисления: всегда +2 (в соединениях).
- Химическая активность: настолько высока, что радий мгновенно окисляется на воздухе и бурно реагирует с водой.
Период (7‑й)
Находится в 7‑м периоде — его электроны распределены по семи энергетическим уровням.
Влияние на свойства:
- Максимальный радиус: Среди элементов своей группы радий обладает самым большим атомным радиусом, что делает его электроны наиболее «подвижными».
- Естественная радиоактивность: В отличие от легких аналогов (кальция, магния), радий не имеет стабильных изотопов и постоянно распадается, превращаясь в радон.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(Ra) ≈ [226] а.е.м. (для наиболее распространенного изотопа 226Ra).
- Определение: средняя масса нуклида, входящего в состав урановых руд.
- Стабильность: Изотоп 226Ra имеет период полураспада около 1600 лет, что делает его достаточно «живучим» для накопления в земной коре.
Все значения для всех элементов можно узнать в таблице атомных масс.
s‑Элемент (электронное семейство)
Застраивающимся является внешний 7s‑подуровнь (7s2).
Специфика блока: Это типичный представитель s-блока. Его свойства определяются парой внешних электронов, которые он крайне легко отдает, превращаясь в двухзарядный катион Ra2+.
Определение энергетических уровней Радия по Таблице Менделеева
Положение Радия (Ra) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 7-й период (Количество этажей)
Радий находится в седьмой строке таблицы. Номер периода совпадает с количеством энергетических уровней.
- Итог: У Радия 7 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Радия — 88. Распределение электронов по слоям:
Ra ) 2 ) 8 ) 18 ) 32 ) 18 ) 8 ) 2
Для сравнения: У соседа сверху, Бария (56), 6 уровней, а у Радия (88) добавляется 7-й уровень с парой электронов.
3. 2-я группа (Химический характер)
Радий — щелочноземельный металл.
- s-элемент: Его металлическая природа выражена максимально сильно.
- Место в блоке: Он является самым энергичным восстановителем в своей группе.
Проверка знаний: Как определить радий по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Радий (Ra) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 88. Точное место Радия в ряду элементов.
- 2) 2-я группа. Здесь он соседствует с кальцием, стронцием и барием.
- 3) s-элемент 7-го периода. Это определяет его структуру (7 оболочек) и химическую активность.
- 4) Ошибка. Для шаров используют гелий; радий — тяжелый и опасный металл.
- 5) Ошибка. Радий — один из самых известных радиоактивных элементов.
- 6) Ошибка. Радий находится во 2-й группе, а кислород — в 16-й.
Часто задаваемые вопросы:
Радий расположен в 7-м периоде и 2-й группе. Его атомный номер — 88.
У него 7 энергетических уровней, так как он находится в 7-м периоде.
Радий относится к s-элементам и является щелочноземельным металлом.