Теория:
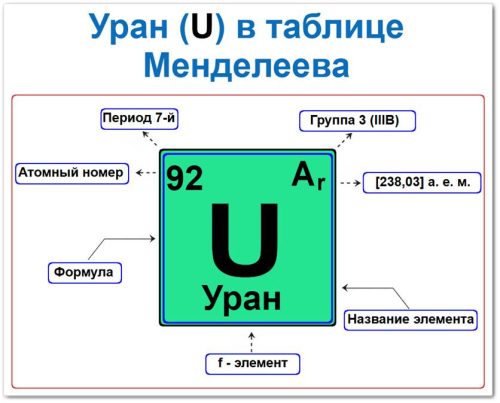
Уран (U) в периодической системе: 7‑й период, 3‑я группа (по устаревшей классификации — IIIB), атомная масса 238.0289 а.е.м.
Занимает положение в 7‑м периоде, что определяет его принадлежность к семейству актиноидов.
Это самый тяжелый химический элемент, встречающийся в природе в заметных количествах.
Будучи химическим гомологом (аналогом) лантаноида неодима, уран проявляет свойства типичного радиоактивного металла.
Однако, в отличие от многих других актиноидов, уран способен проявлять высокие степени окисления (до +6), что делает его химию невероятно разнообразной.
А его нахождение в 3‑й группе (семейство актиноидов) задает ключевые параметры: базовое строение электронной оболочки f-типа, а также формирование сложных катионов, таких как уранил-ион (UO22+).
Структура атома подтверждается его электронной формулой (конфигурацией):
[Rn] 5f3 6d1 7s2.
На которой наглядно можно определить его положение как f-элемента, стоящего за протактинием и перед нептунием.
Уран в таблице Менделеева можно определить на основании закона периодичности: положение в группе и периоде, а также порядкового номера / атомный номер (Z = 92)
Как определить положение Урана в Таблице Менделеева
Локация урана в таблице описывается характеристиками его природного радиоактивного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (в ряду актиноидов).
- Период (горизонтальный ряд).
- Электронное семейство (уран — f‑элемент).
Порядковый номер / атомный номер (Z = 92)
- Служит уникальным кодом элемента как главного топлива атомной промышленности.
- В ядре — 92 протона; в нейтральной оболочке — 92 электрона.
- Электронное строение: [Rn] 5f3 6d1 7s2.
Важно: Наличие электронов на 5f- и 6d-подуровнях позволяет урану легко отдавать электроны, проявляя широкий спектр степеней окисления.
Название и символ
- Название: «уран» (в честь планеты Уран, открытой незадолго до самого элемента).
- Символ: U.
- Примечание: Открыт Мартином Клапротом в 1789 году в виде оксида, а в металлическом виде получен в 1841 году Эженом Пелиго.
Группа (3 / III B)
Расположен в 3‑й группе (формально, как часть семейства актиноидов), что объединяет его с другими f-элементами 7-го периода.
Химический потенциал:
- Валентность урана: высшая валентность VI.
- Степень окисления: возможны +3, +4, +5 и наиболее устойчивая +6 (в соединениях с кислородом).
Период (7‑й)
Находится в 7‑м периоде — его электроны распределены по семи энергетическим уровням.
Влияние на свойства:
- Природная радиоактивность: Все изотопы урана нестабильны. Основной изотоп 238U имеет период полураспада 4,5 миллиарда лет, что сопоставимо с возрастом Земли.
- Плотность: Уран — очень тяжелый металл (плотность 19,1 г/см³), почти такой же тяжелый, как золото или вольфрам.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(U) = 238.0289 а.е.м.
- Определение: средневзвешенное значение масс природных изотопов (в основном 238U, 235U и 234U).
- Энергетика: Изотоп уран-235 способен к цепной ядерной реакции деления, что делает этот элемент основой атомной энергетики.
Все значения для всех элементов можно узнать в таблице атомных масс.
f‑Элемент (электронное семейство)
Застраивающимся является 5f‑подуровень (5f3).
Специфика блока: Как f-элемент, уран обладает уникальными магнитными свойствами и способностью к образованию сложных комплексных соединений, окрашенных в яркие цвета (желтый, зеленый).
Определение энергетических уровней Урана по Таблице Менделеева
Положение Урана (U) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 7-й период (Количество этажей)
Уран находится в седьмой строке таблицы. Номер периода совпадает с общим числом электронных слоев.
- Итог: У Урана 7 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Урана — 92. Его 92 электрона распределены по уровням следующим образом:
U ) 2 ) 8 ) 18 ) 32 ) 21 ) 9 ) 2
Для сравнения: У соседа слева, Протактиния (91), на пятом уровне 20 электронов, а у Урана (92) — 21.
3. 3-я группа (Химический характер)
Уран входит в семейство актиноидов.
- f-элемент: Его свойства определяются частичным заполнением 5f-оболочки.
- Место в блоке: Он является «тяжелым аналогом» неодима (Nd), хотя химически уран гораздо активнее в высших степенях окисления.
Проверка знаний: Как определить уран по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Уран (U) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 92. Это фундаментальное положение урана в таблице.
- 2) 7-й период и актиноиды. Точное «географическое» положение элемента.
- 3) Природный f-элемент. Уран — самый тяжелый из встречающихся в земной коре элементов.
- 4) Ошибка. Для карандашей используют графит (Углерод).
- 5) Ошибка. Уран относится к 3-й группе (актиноиды), а не к 16-й.
- 6) Ошибка. Уран — тяжелый радиоактивный металл.
Часто задаваемые вопросы:
Расположен в 7-м периоде, атомный номер 92. Относится к семейству актиноидов (вынесены в нижнюю часть таблицы, соответствуют 3-й группе).
У атома Урана 7 энергетических уровней (электронных слоев), так как он находится в 7-м периоде.
Это последний элемент в таблице Менделеева, который существует в природе в значимых количествах; все элементы после него (трансураны) получены искусственно.