Ra радий (Radium; от лат. radius — луч) — радиоактивный химический элемент 2-й группы, с порядковым номером 88 в периодической системе.
Атомный номер 188, атомная масса 226,0254. Находится в седьмом периоде. Температура плавления: 700 °С, температура кипения 1737 °С. Плотность: 5.5 г/см3.
Электронная формула
Полная электронная формула атома радия в порядке возрастания энергий орбиталей:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2
Сокращенная электронная конфигурация Ra:
[Rn] 7s2
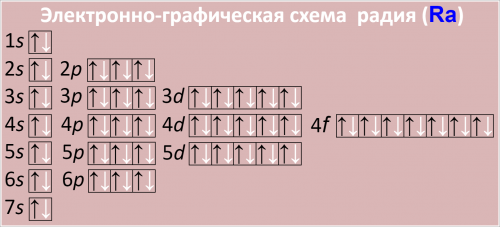
Электронная формула атома радия в порядке следования уровней:
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p6 7s2
Электронно-графическая схема радия (Ra)
Рис. Схема распределения электронов по атомным орбиталям в атоме радия.
Энергетические уровни
Распределение электронов по орбиталям в атоме радия:
88 Ra )2 )8 )18 )32 )18 )8 )2
Распределение электронов по энергетическим уровням в атоме Ra:
- -й уровень (K): 2
- -й уровень (L): 8
- -й уровень (M): 18
- -й уровень (N): 32
- -й уровень (O): 18
- -й уровень (P): 8
- -й уровень (Q): 2
Рис. Распределение электронов по энергетическим уровням в атоме радия.
Валентные электроны радия
Количество валентных электронов в атоме — 2.
Таблица квантовых чисел Ra (N — главное, L — орбитальное, M — магнитное, S — спин).
| Орбиталь | N | L | M | S |
| s | 7 | 0 | 0 | +1/2 |
| s | 7 | 0 | 0 | -1/2 |
В соединениях радий проявляет степень окисления: +2.
Стабильные изотопы
Стабильных изотопов не имеет.
Известны 14 природных и искусственных изотопов радия, с массовыми числами 213Ra и от 218Ra до 230Ra.
Наиболее долго живущими являются изотопы 226Ra, 228Ra, 225Ra, 223Ra и 224Ra с периодами полураспада соответственно 1620 лет; 6,7 года; 14,8; 11,68 и 3,64 суток.
Наибольшее практическое значение имеет естественный радиоактивный изотоп 226Ra — элемент радиоактивного ряда урана.


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.