Валентность и типы химической связи
Рис. Схема взаимного перекрывания s-орбиталей в молекуле водорода
Валентность элементов зависит от электронной структуры атома и проявляется только при образовании химических соединений.
Рассмотрим, например, как образуется из двух атомов водорода молекула водорода.
Как известно, атом водорода имеет один s-электрон.
Если сталкиваются два атома водорода, имеющие s-электроны с антипараллельными спинами, то эти электронные облака могут частично перекрывать друг друга, образуя электронную пару, принадлежащую двум атомам водорода одновременно, что прочно связывает оба атома в единую молекулу (рис. 1).
При образовании химической связи происходит взаимное перекрывание орбиталей.
Условно обобществление электронной пары при образовании химической связи изображают следующим образом:
Точки обозначают два обобществленных электрона. Такая химическая связь, образованная посредством общих электронных пар, носит название ковалентной связи.
Однако ковалентная связь, образованная при помощи пары s-электронов, встречается только у водорода.
В других молекулах она обычно бывает образована либо двумя р-электронами, облака которых имеют гантеле-видную форму, либо одним s— и одним р-электроном.
Образование молекулы фтора
Примером может служить образование молекулы фтора F2.
Атом фтора имеет на внешнем электронном слое один неспаренный р-электрон. Образование молекулы фтора приводит к взаимному перекрыванию двух р-электронных облаков.
Условно это можно изобразить так:
В этом случае оказывается завершенным до октета внешний электронный слой каждого атома.
Каждый атом фтора имеет 6 собственных электронов (принадлежащих как к s-так и к р-оболочкам) и 2 обобществленных и того 8 электронов.
Может быть также случай, когда обобществляется не одна, а несколько электронных пар.
Например, при образовании молекулы азота:
В этом случае каждый атом азота имеет на внешнем слое по 2 собственных и 6 (3 пары) обобществленных электронов.
➡️ 35. Объясните образование ковалентной связи в молекуле хлора Сl2, кислорода O2. (См. Ответ)
Ковалентность
До сих пор мы рассматривали ковалентную связь, образованную электронами двух одноименных атомов.
Однако значительно чаще бывают случаи, когда такая связь возникает между разноименными атомами.
Например, в молекуле метана СН4 она возникает между атомом углерода и четырьмя водородными атомами:
В молекуле двуокиси углерода СO2 между двумя атомами кислорода и атомом углерода:
и т. д.
Валентность элементов в такого рода соединениях называется ковалентностью.
Например, углерод в составе молекулы двуокиси углерода четырехковалентен, а кислород — двухковалентен.
Величина ковалентности каждого атома определяется числом образованных им электронных пар.
Одновременно не свойства образованной разноименными атомами ковалентной связи оказывает влияние разная электро-отрицательность элементов.
Атом, обладающий большей электроотрицательностью, с большей силой притягивает к себе общие электронные пары, вызывая их смешение.
Например, в молекуле метана СН4 общие электронные пары смещены в центр молекулы к атому углерода как к более электроотрицательному, в молекуле двуокиси углерода — к атомам кислорода.
Естественно ожидать возникновения около атомов кислорода избыточного отрицательного, а около атомов водорода избыточного положительного заряда.
Рис. 2. Схема взаимного перекрещивания при образовании химической связи.
Однако, благодаря тому, что молекулы СН4 и СО2 симметричны, явление смещения электронных пар при химических процессах не проявляется.
Иначе обстоит деда, если молекула не симметрична, как, например, HCl хлористый водород.
Ковалентная связь образуется здесь за счет взаимного перекрывания одного непарного s-электронного облака водорода и одного непарного p-электронного облака хлора (рис. 2).
Все остальные орбита ли внешнего электродного слоя хлора парные.
Условно это обозначается так:
Однако электроотрицательность хлора значительно выше, чем водорода, поэтому общая электронная пара сильно смещается к хлору.
В результате у хлора возникает отрицательный заряд, а на другом конце молекулы (у атома водорода) — положительный заряд ядра.
В молекуле обнаруживаются как бы два полюса — положительный и отрицательный. Такая молекула носит название полярной молекулы, или диполя.
Ковалентная связь, при которой происходит смещение электронных пар к более электроотрицательному атому, называется полярной связью.
Полярная связь не всегда приводит к образованию диполя.
Например, в случае:
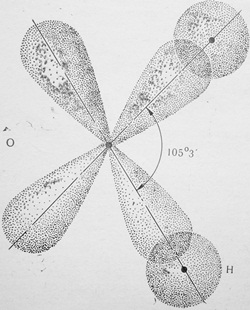
Рис. 3. Схема образования химической связи с валентным углом 105 °3′ при перекрывании s— и р-орбиталей в молекуле воды формирования молекулы двуокиси углерода смещение электронных пар происходит, но диполь не возникает, так как молекула симметрична.
Несимметричными являются полярные молекулы воды, аммиака, сероводорода и т. д.
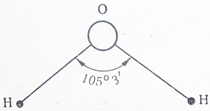
Молекула воды образована одним атомом кислорода, имеющим 6 электронов на внешнем слое (из них два непарных р-электрона), и двумя атомами водорода, имеющими по одному непарному s-электрону.
Как известно, р— орбитали располагаются вокруг ядра во взаимно перпендикулярных плоскостях под прямым углом.
При образовании связи происходит взаимное перекрывание р-орбиталей кислорода и s-орбиталей водорода.
При этом s-орбитали двух водородных атомов слегка отталкиваются, увеличивая угол между р-орбиталями кислорода до 105°3′ (рис. 3). Возникший угол называют валентным углом.
Смещение общих электронных пар к сильно отрицательному кислороду также приводит к образованию диполя.
Электроны, участвующие в образовании химической связи, носят название валентных электронов. Чаще всего валентными являются электроны внешнего электронного слоя.
Однако в образовании химической связи могут принимать участие и электроны более глубокого предвнешнего слоя.
➡️ 36. Объясните образование полярной ковалентной связи в молекулах НВr, H2S. (См. Ответ)
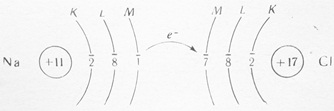
Нередко, если различие в электроотрицательности элементов достаточно велико, может произойти не просто смещение электронов в сторону более электроотрицательного элемента, а полная передача электронов от одного атома к другому.
Например, при возникновении химической связи между атомами натрия и хлора валентный электрон натрия полностью переходит на внешний электронный слой хлора, достраивая его до восьми-электронной структуры:
При этом атом хлора приобретает избыточный отрицательный заряд — 1, превращаясь из нейтрального атома в отрицательно заряженный ион.
Атом натрия, лишившись одного электрона, приобретает положительный заряд +1, превращаясь из нейтрального атома в положительный ион.
Разноименно заряженные ионы, притягиваясь друг к другу силой электростатического притяжения, образуют молекулу хлорида натрия.
Записать этот процесс можно следующим образом:
Такая молекула называется ионной, так как она образована ионами.
Химическая связь в этом случае также называется ионной или электровалентной. Валентность элементов в таких соединениях называют электровалентностью.
Молекулы с ионным типом химической связи возникают в том случае когда соединяются атомы элементов с резко различной электроотрицательностью — типичного металла и типичного неметалла. Это могут быть элементы начала и конца периода.
➡️ 37. Объясните образование ионной связи в молекулах бромида калия KBr, сульфида натрия Na2S, нитрида магния Mg3N2. (См. Ответ)
Ковалентная неполярная связь характерна для простых веществ — неметаллов, молекулы которых состоят из одноименных атомов, например Cl2, O2,N2 и т. д.
Когда соединяются разноименные атомы неметаллов, электроотрицательность которых различна, тогда неминуемо возникает полярная связь.
Однако, в зависимости от взаимного пространственного расположения атомов, молекула в целом может быть полярной или неполярной.
Например, молекула НСl полярна, так как имеет линейный характере молекула воды Н2О также полярна — она плоская с валентным углом 105°3′ (рис. 4).
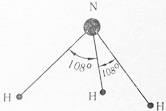
Молекула аммиака NH3 также полярна, так как имеет форму трехгранной пирамиды с атомом азота на вершине. Валентный угол 108° (рис. 5).
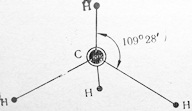
Молекула СН4 неполярна, так как имеет форму тетраэдра с атомом углерода в центре. Валентный угол 109°28′ (рис. 6).
Таким образом, полярность молекулы в целом зависит от ее состава и взаимного пространственного расположения атомов.
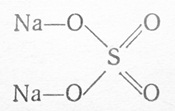
В сложных молекулах часто сочетаются разные типы химической связи.
Например, в молекуле сульфата натрия Na2SO4 атомы натрия соединены с кислородом посредством ионной связи, а сера с кислородом — посредством ковалентной связи
Вторичная зональность сульфидных месторождений.
Таких примеров можно привести очень много.
Рис. 4. Схема строения молекулы воды с валентным углом 105°3′
Рис. 5. Схема строения молекулы аммиака с валютным углом 108°
Рис. 6. Схема строения молекулы метана с валютным углом 109°28′
■ 38. Среди перечисленных ниже формул веществ найдите вещества с ионными, полярными и неполярными молекулами и объясните, как они построены: НВr, H2O, СО, РН3, CaS, ZnCl2, SiH4, CCl4 (См. Ответ)
Другие типы химических связей (металлическая, во-дородная, донорно-акцепторная) будут рассмотрены ниже.
Кристаллические решетки
Все до сих пор сказанное о химической связи между атомами касалось только отдельно взятых молекул.
Но говоря о вещество, было бы неправильно рассматривать только отдельные молекулы так как не даёт целостного представления о веществе.
Почти все твердые вещества в обычных условиях находятся в виде кристаллов. Структуру кристаллов называют кристаллической решеткой. Она может быть образована как одинаковыми, так и разными частями.
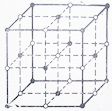
У хлорида натрия NaCl кристаллическая решетка образована ионами Na+ и Сl— (рис. 7), поэтому она называется ионной. В ее узлах поочередно располагаются ионы натрия и хлора.
Они связаны друг с другом силами электростатического притяжения. Кристалл представляет собой как бы единое целое.
Рис. 7. Схема кристаллической решетки хлорида натрия.
Таким образом, в твердом агрегатном состоянии (в кристаллах) мы находим только ионы Na+ и Сl—. Лишь в газообразном состоянии (в парах) NaCl существует в виде молекул.
Рис. 8. Схема атомной кристаллической решетки алмаза
Кристаллическая решетка может быть образована не ионами, а атомами.
Например, в узлах кристаллической решетки алмаза (рис. 8) или графита находятся атомы углерода, связанные между собой ковалентной химической связью.
Таким образом, кристалл представляет собой как бы гигантскую молекулу.
Рис.9. Схема молекулярной кристаллической решётки йода.
Такие кристаллические решетки называются атомными.
Формулу простого вещества иода записывают I2, подчеркивая, что молекулы иода состоят из двух атомов.
В узлах кристаллической решетки иода располагаются молекулы I2 (рис. 9), поэтому такая кристаллическая решетка называется молекулярной.
Молекулярные кристаллические решетки могут быть образованы молекулами не только простых веществ, но и сложных, таких, как двуокись углерода (в твердом виде «сухой лед»), вода (в твердом виде лед) и т. д.
Среди всех видов кристаллических решеток молекулярные — самые непрочные, так как удерживаются только за счет сил межмолекулярного притяжения без участия энергии химической связи. Наиболее прочные решетки — атомные, где имеет место ковалентная связь.
➡️ 39. Почему температура плавления воды намного ниже температуры плавления углерода?
40. Как можно, зная температуру плавления и другие физические свойства вещества, прийти к заключению о характере его кристаллической решетки?
41. В чем различие ионных, атомных и молекулярных кристаллических решеток?(См. Ответ)
Определение с помощью периодической системы элементов валентности элементов и формул их высших окислов
Периодическая система элементов позволяет по положению в ней того или иного элемента находить формулу его соединений с другими элементами, определять характер химической связи в их молекулах и их свойства.
Номер группы в периодической системе численно равен высшей валентности любого элемента данной группы в соединениях с кислородом.
Например, для серы, элемента VI группы, она равна 6, для фосфора, элемента V группы, — 5, стронция, элемента II группы, — 2. На основе теории строения атома это легко объяснимо.
Внешний электронный слой этих элементов имеет соответственно 6, 5 и 2 валентных электрона. При соединении с более электроотрицательным элементом, например с кислородом, образуется столько валентных связей, сколько имеется валентных электронов.
При этом электроны сильно смещаются в сторону наиболее электроотрицательного атома (например, SO3, P2O5).
А иногда (при образовании электровалентной связи) и совсем отрываются и переходят к последнему, в результате чего возникают такие соединения, как высшие окислы SrО, Na2O и т. д.
Высшую валентность в соединениях с кислородом, численно равную номеру группы, проявляют элементы не только главных подгрупп, но и побочных, несмотря на то что на внешнем электронном слое их атомов чаще всего бывает 1 — 2 электрона, независимо от того, в какой группе они находятся.
Например, хорошо известен окисел Mn2O7, где валентность марганца (элемента VII группы) равна 7, несмотря на то что внешний электронный слой атома марганца имеет 2 электрона.
Ванадий (элемент V группы) в высшем окисле V2O5 проявляет валентность 5, хотя внешний электронный слой ванадия имеет лишь 2 электрона.
Это объясняется тем, что в образовании химической связи принимают участие не только электроны внешнего слоя, но и предвнешнего, электронные оболочки которого не полностью застроены.
Правда, для вовлечения в процесс электронов более глубокого слоя нужна большая энергия, поэтому такие соединения обычно поручить труднее.
➡️ 42. Какова высшая валентность в соединениях с кислородом элементов ниобия, галлия, технеция?
43. Какова высшая валентность в соединениях с кислородом элементов олова, сурьмы, таллия?
44. Напишите формулы высших окислов кадмия, галлия, гафния.
45. Напишите формулы высших окислов азота, углерода, лития.
Пользуясь периодической системой элементов, можно определить характер свойств окисла того или иного элемента и формулу его гидроокиси.
Для того чтобы суметь определить это по периодической системе элементов, нужно хорошо знать как они классифицируются и свойства для них типичны. (См. Ответ)

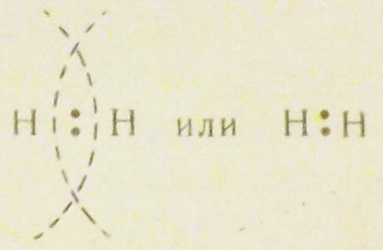


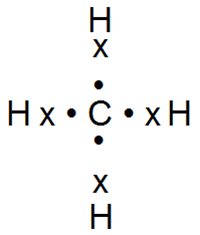
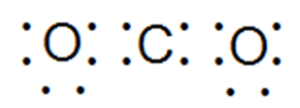


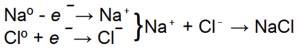



Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.