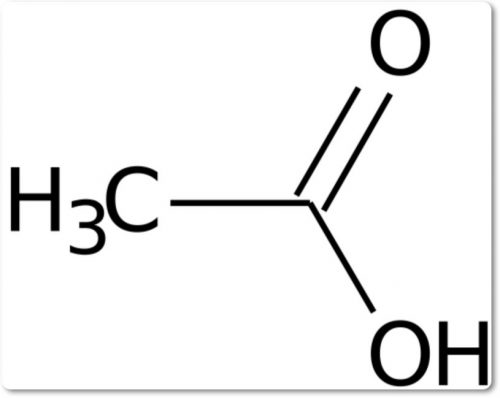
Уксусная кислота это органическое соединение, относящееся к группе карбоновых кислот. Его формула CH3COOH, где метильная группа присоединена к карбоксильной функциональной группе.
Его название IUPAC-этановая кислота. Уксусная кислота является основным компонентом уксуса и известна с древних времен.
Раствор уксуса содержит уксусную кислоту и воду, где этановая кислота составляет от 5 до 20% по объему. Уксусная кислота в уксусе отвечает за его резкий запах и кислый вкус.
Он также имеет множество других важных применений. Здесь мы также узнаем о физических и химических свойствах уксусной кислоты.
Что такое уксусная кислота
Этановая кислота-вторая по простоте карбоновая кислота.
- Структура этановой кислоты приведена CH3COOH.
- В твердом состоянии уксусной кислоты существует цепочка молекул с отдельными молекулами, соединенными водородными связями.
- В парообразном состоянии его димеры находятся при температуре около 120°C.
- Когда он находится в жидкой фазе, его димеры обнаруживаются в разбавленном растворе.
Структура уксусной кислоты:
Уксусная кислота с химической формулой CH3COOH также известна как этановая кислота. Это бесцветная жидкость с характерным резким запахом.
Это органическое соединение растворимо в воде и более кисло, чем H2О, но менее кисло, чем минеральные кислоты.
5-8% уксусной кислоты в воде называется уксусом и широко используется в качестве консервантов в соленых огурцах.
Структура CH3COOH в твердом состоянии существует в цепочке молекул, и они связаны друг с другом водородными связями.
Неразбавленная его версия также известна как ледяная уксусная кислота, потому что она имеет температуру плавления 16 ° C и, следовательно, часто замерзает зимой, когда погода холодная.
Молярная масса CH3COOH
По расчетам, молярная масса уксусной кислоты составляет 60,05 г/моль.
Его можно рассчитать как:
(2 × 12.011) + (4 × 1.00794) + (2×15.999) г/моль = 60,05 г/моль
Физические свойства уксусной кислоты
Некоторые важные физические свойства уксусной кислоты перечислены ниже:
- Этановая или уксусная кислота имеет резкий уксусный запах и кислый вкус.
- Это бесцветная жидкость.
- Он закипает при 391 тыс.
- Его плотность в жидком виде составляет 1,049 г/см3.
- Он может смешиваться с водой, спиртом, эфиром во всех пропорциях.
- В воде он растворяется с выделением тепла и уменьшением объема.
- Он агрессивен по своей природе и вызывает появление волдырей при контакте с кожей.
В нем растворены сера, йод и многие другие органические соединения.
Температура плавления уксусной кислоты
Температура плавления уксусной кислоты составляет 289,5 К или 16,5°С.
При охлаждении ниже этой температуры он образует кристаллы, похожие на лед. Поэтому чистую и безводную кислоту обычно называют ледяной уксусной кислотой, где ледяная означает ледяная.
Химические свойства уксусной кислоты
Уксусная кислота является второй простейшей формой метильной группы, содержащей карбоновую кислоту, с химическим названием CH3 и связана с группой карбоновых кислот (COOH).
Другими словами, мы можем сказать, что это ацетильная группа (CH3CO), связанная с гидроксильной группой (OH).
Структура CH3COOH показывает, что она содержит гибридизацию sp 2.
Этановая кислота ведет себя как димер в жидком и парообразном состоянии из-за межмолекулярной водородной связи.
На рисунке 2 показана структура уксусной кислоты.
Кислотность (Реакция с металлами, щелочами)
1. Известно, что этановая кислота вступает в реакцию с активными металлами, такими как Na, с выделением водорода.
Эта реакция аналогична реакции этанола:
CH3COOH + Na → CH3COONa+H2
2. Уксусная кислота вступает в реакцию с NaOH с образованием соли и воды:
CH3COOH + NaOH → CH3COONa + H2O
3. CH3COOH также вступает в реакцию с карбонатом натрия и гидрокарбонатом натрия, которые являются более слабыми основаниями и выделяют CO2:
Na2CO3 + 2 CH3COOH → 2 CH3COONa + CO2 + H2O
CH3COOH + NaHCO3 → NaC3COO + H2O + CO2
Хлориды кислот
Она вступает в реакцию с тионилхлоридом и образует ацетилхлорид.
CH3COOH + SOCl2 → CH3COCl + HCl + SO2
Кислотный ангидрид
Уксусная кислота вступает в реакцию с хлоридом кислоты в присутствии основания и высвобождает уксусный ангидрид.
CH3CO2H → CH2 =C=O + H2O
CH3CO2H + CH2=C=O → (CH3CO)2O
Эфир
Когда любой спирт вступает в реакцию с любой карбоновой кислотой, он образует сложные эфиры.
Когда уксусная кислота вступает в реакцию с этиловым спиртом, это приводит к образованию этилэтаноата.
CH3COOH + C2H5OH → CH3COOC2H5 + H2O
CH3COOH в качестве растворителя
Уксусная кислота является полярным протонным растворителем. Это кислотный растворитель, так как он может передавать ион H+ растворяемому веществу.
Он часто используется в таких реакциях, как алкилирование Фриделя-Крафта. С его помощью можно получить терефталевую кислоту.
Некоторые важные химические свойства уксусной кислоты приведены ниже:
- Карбоксильная функциональная группа в этановой кислоте вызывает ионизацию соединения, получаемого в результате реакции: CH3COOH ⇌ CH₃COO⁻ + H⁺
- Кислотное качество уксусной кислоты обусловлено высвобождением протона, описанного выше в равновесной реакции.
- В растворе воды константа кислотной диссоциации (pKa) этановой кислоты 4,76.
- CHCOO⁻, ацетат является конъюгированным основанием уксусной кислоты.
- Уксусная кислота не диссоциирует полностью, так как видно, что рН раствора этановой кислоты с концентрацией 1,0 М составляет 2,4.
- Уксусная кислота-полярный протонный растворитель с диэлектрической проницаемостью 6,2 в жидкой форме.
Получение Уксусной Кислоты
Этановая кислота получают промышленным способом главным образом путем карбонилирования. Этот процесс состоит из трех этапов:
- CH3OH + HI → CH3I + H2O
- CH3I + CO → CH3COI
- CH3COI + H2O → CH3COOH + HI
Другие Методы
Окисление ацетальдегида:
2CH3CHO + O2 → 2 CH3CO2Н
При некоторых условиях и с использованием катализаторов может образовываться уксусная кислота.
В этой реакции образуется несколько значительных побочных продуктов, например муравьиная кислота, этилацетат и т.д.
Окисление этилена
В присутствии палладиевого катализатора мы можем получить уксусную кислоту из этилена.
C2Н4 + O2 → CH3CO2Н
Окислительная ферментация
В присутствии достаточного количества кислорода уксуснокислые бактерии могут производить этановую кислоту из пищевых продуктов.
C2H5OH + O2 → CH3COOH + H2O
Анаэробное Брожение
C6H12O6 → 3CH3COOH
Некоторые анаэробные бактерии, такие как ацетобактерии, могут превращать сахар непосредственно в уксусную кислоту.
Помимо этих методов, исследователи также пытаются получить уксусную кислоту путем окисления отходящих газов промышленных процессов.
Реакции с уксусной кислотой
Уксусная кислота подвергается почти всем реакциям карбоновой кислоты.
- Уксусная кислота подвергается разложению при нагревании выше 440°C с образованием либо метана и двуокиси углерода, либо воды и этанола, указанных в уравнениях.
CH3COOH + Тепло → CO + CH4
CН3COOH + Тепло → H2C=C=O + H2O
- При воздействии уксусной кислоты некоторые металлы, такие как магний, железо и цинк, подвергаются коррозии. Эта реакция приводит к образованию ацетатных солей. Когда магний вступает в реакцию с уксусной кислотой, он дает ацетат магния и водород, указанные в уравнении.
2CH3COOH + Mg → Mg(CH3COO)2 (ацетат магния) + H2
- Ацетатные соли образуются, когда уксусная кислота вступает в реакцию со щелочами, как описано в уравнении.
CH3COOH + КОН → CH3COOHК + Н2О
- Соединения, образующиеся при реакции с карбонатами, представляют собой соли ацетата, воду и диоксид углерода.
2CH3COOH + Na2CO3 (карбонат натрия) → 2CH3COONa +CO2 + H2O
CH3COOH + NaHCO3 (бикарбонат натрия) → CH3COOHNa +CO2 +H2O
Применение уксусной кислоты
- Этановая кислота используется в производстве различных красителей, пластмасс, тканей, шелка и парфюмерии.
- Его проще всего использовать в качестве столового уксуса.
- В медицине он используется как местное раздражающее средство.
- В резиновой промышленности он также используется в качестве коагулянта.
- Он также используется в качестве коагулирующего агента в резиновой промышленности.
- Он полезен при производстве ацетата, ацетона и сложных эфиров, используемых в различных отраслях промышленности.
- Он широко используется в производстве VAM (мономера винилацетата).
- При лечении рака его вводят непосредственно в опухоль.
- Уксусная кислота обладает желательными свойствами растворителя, а также способностью образовывать смешиваемые смеси как с полярными, так и с неполярными соединениями. Следовательно, это очень важный промышленный растворитель. Он широко используется в промышленном производстве диметилтерефталата (ДМТ).
- Это активное бактерицидное дезинфицирующее средство, которое также эффективно против большинства других бактерий.
Часто задаваемые вопросы?
Какие физические свойства у уксусная кислота?
Физические свойства уксусной кислоты. Уксусная кислота в чистом виде – это бесцветная жидкость, которая имеет плотность 1, 05 г/см2. Она способна интенсивно поглощать влагу из воздуха.
Достигая температуры 16,6°С кислота кристаллизуется в бесцветные кристаллы, плотность которых – 1,105 г/см2.
Какая это кислота CH3COOH?
Уксусная кислота (CH3COOH) – это концентрированный уксус, знакомый человечеству с давних времён. Его изготовляли путём брожения вина, т.е. углеводов и спиртов.
Сколько процентов уксусная кислота?
Уксусную кислоту, концентрация которой близка к 100 %, называют ледяной. 70—80%-й водный раствор уксусной кислоты называют уксусной эссенцией, а 3—15%-й — уксусом.
Какова плотность ледяной уксусной кислоты?
100% уксусная кислота («ледяная») имеет плотность около 1,05 кг/л, таким образом при росте концентрации CH3COOH плотность раствора сначала возрастает, но затем (при концентрациях от 80% до 100%) убывает до 1,05 кг/л. С ростом температуры плотность раствора снижается.
Приведите некоторые методы приготовления уксусной кислоты?
В промышленности уксусную кислоту получают карбонилированием метанола. Эти два соединения вступают в реакцию с образованием промежуточного продукта йодистого метила, который затем вступает в реакцию с монооксидом углерода.
Полученное соединение вступает в реакцию с водой с образованием уксусной кислоты. Здесь карбонильный комплекс необходим в качестве катализатора на второй стадии.
Уравнения процесса подготовки являются:
CH3OH (метанол) + HI (йодистый водород) → CH3I (промежуточное соединение йодистого метила) + H2O
CO (монооксид углерода) + CH3I → CH3COI (ацетил иодид)
H2O+CH3COI→ CH3COOH (уксусная кислота) + HI
Другим методом подготовки является:
Он также может быть получен окислением ацетальдегида, где в качестве металлических катализаторов могут быть использованы нафталиновые соли кобальта, хрома и марганца.
2CH3CHO+ O2 → 2CH3COOH.
В чем может заключаться опасность уксусной кислоты?
Хотя уксусная кислота является слабой кислотой, но ее концентрированная форма вызывает коррозию кожи, которая вызывает волдыри и ожоги.
Длительное воздействие паров уксусной кислоты при вдыхании около восьми часов при 10 промилле может вызвать некоторое раздражение глаз, носа и горла.
Раздражение легких и возможное повреждение легких, глаз и кожи могут привести к 100 промилле.
Работники, контактирующие с уксусной кислотой в течение длительного периода, могут страдать бронхитом, фарингитом, эрозией открытых зубов, а также конъюнктивитом.
Таким образом, в основном опасность зависит от концентрации кислоты.


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.