ЧТО ТАКОЕ БЕЛКИ
Звенья образующей цепи соединены перемычкой типичной для полипептидов рис. 2.
Так как белки обладают большой молекулярной массой и состоят, как правило, из сотен остатков аминокислот, то перестановки аминокислотных остатков, очевидно, могут привести к образованию огромного числа изомеров. Если белок содержит всего 12 различных аминокислот и имеет 288 пептидных связей типа СО—NH, то можно получить не менее 10130 изомеров этого белка.
Это практически неисчерпаемое многообразие является колоссальным резервом для создания индивидуальных наборов белков. В сущности каждая особь данного вида (например, человек, организм которого содержит около 100 000 различных белков) может иметь «свои белки». На самом деле между белками организмов одного и того же вида всегда имеются тонкие индивидуальные различия.
Даже люди, являющиеся близкими родственниками, имеют не вполне одинаковый набор белков. Это обстоятельство не случайно — оно представляет собой выражение глубокой закономерности. Индивидуальный химический состав обеспечивает химическую изоляцию и устойчивость организма.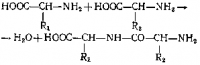
Клетки отвергают все другие белки, кроме тех, из которых состоит данный организм. Это до известной степени гарантирует слаженную работу всех механизмов и избавляет их от неожиданных химических воздействий чужих веществ. По-видимому, в упорном нежелании изменять набор белков кроется причина тканевой несовместимости.
Известно, что удачно выполненная пересадка органа (например, операции пересадки сердца) часто в конечном счете завершалась печально— пересаженный и как будто уже прижившийся орган отторгался — организм отказывался признать его своим. Такой результат закономерен; если бы можно было легко изменять белковые компоненты клеток, то изменялись бы и все характерные свойства организма, выработанные тысячелетиями борьбы за существование.
При этом, конечно, уменьшились бы шансы на сохранение жизненной устойчивости. Вот почему так трудно преодолевать тканевую несовместимость — это в общем очень полезное свойство, обеспечивающее оптимальные химические условия устойчивости. Иногда даже незначительные изменения в порядке следования аминокислот способны привести к тяжелым нарушениям нормальной работы систем организма.
Молекулярная масса белков
Молекулы белков являются макромолекулами и состоят из тысяч атомов. Когда белки находятся в изоэлектрическом состоянии, их частицы особенно легко соединяются друг с другом за счет взаимодействия противоположно заряженных концов. От этого увеличивается молекулярная масса их и из отдельных молекул возникает крупный агрегат.
Нарастание массы белковой частицы в свою очередь ведет к уменьшению растворимости белка, т. е. к изменению его физического состояния в организме. По этой причине рН жидкостей организма, например рН крови, имеет огромное значение для нормального протекания процессов жизнедеятельности.
Молекулярная масса белков изменяется в широких пределах в зависимости от природы белка. Молекулярные массы, определенные различными методами, иногда не совпадают. Все же можно оцепить молекулярные массы распространенных белков следующими числами:
Инсулин 35000
Пепсин 39 000
Альбумин яичный 40 500
Альбумин сывороточный (лошади) 68 000
Гемоглобин 68 000
γ-Глобулин (человека) 176 000
Каталаза (фермент) 250 000
Гемоцианин 8 900 000
Конформация молекулы белка
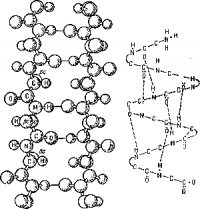
В настоящее время доказано (Нолипг, Уотсон, Крик), что полипептидная цепочка многих белков закручена в спираль, α-спираль (рис. 3) имеет диаметр около 1,0 нм и на один ее виток приходится 3,7 аминокислотных остатков. Водородные связи, придающие спирали жесткость, отмечены на схеме пунктиром.
Рис. 3. α-спираль в молекуле белка.
Справа показано стабилизирующее действие водородных связей (отмечены пунктиром).
Что такое белок
Некоторые белки (фиброин шелка) имеют иную структуру: полипептидные цени в них расположены зигзагообразно (β-форма), причем между лежащими рядом цепочками полипептидов действуют стабилизирующие связи. Молекулы белков, однако, не похожи на пружины. Спираль испытывает дальнейшее изменение формы: она изгибается гак, что получается еще более сложная конфигурация.
Порядок следования аминокислот определяет первичную структуру белка, спирализация—это уже образование вторичной структуры, а изменение общей формы спирали обусловливает третичную структуру. Наконец, большие молекулы белка могут объединяться в еще более крупные агрегаты — формируя уже четвертичные структуры. Трехмерные модели молекул миоглобина и гемоглобина были впервые построены Кендрью в 1957—1961 гг. При этом были использованы данные, ранее полученные Перутцем.
Модель миоглобина (атомарная и объемная) представляет третичную структуру, а модель гемоглобина — четвертичную. Молекула гемоглобина состоит из четырех суб-единиц, расположенных по вершинам почти правильного тетраэдра. В четвертичной структуре индивидуальные полипептидные цепи (протомеры) химически не связаны друг с другом — они образуют отдельные единицы, но в целом вся структура достаточно прочна и, по-видимому, объединена общим действием слабых межмолекулярных сил.
Белок, состоящий из нескольких таких протомеров, называют олигомером. Гемоглобин и многие ферменты являются олигомерами. Отдельные протомеры обладают способностью к «самосборке», т. е. могут при благоприятных условиях образовывать четвертичную структуру данного белка. Этой способностью наделены белки вирусов.
Биологический смысл четвертичной структуры в том, что, создавая белковую частицу из многих «единиц», природа в большой степени гарантирует клетку от случайных «ошибок» в строении той или иной полипептидной цепи. Один пептид неправильного строения может быть легко устранен при формировании олигомера из многих цепей.
В общем случае каждая конформация отличается индивидуальными свойствами. Следовательно, фактически разнообразия в мире белков еще больше, чем это могло показаться при простом подсчете числа изомеров данного полипептида. Форма белковых молекул изменяется мод влиянием различных факторов.
Она зависит, конечно, от природы самого белка, но также и от концентрации ионов водорода в растворе, температуры, наличия солей и т. д. Тем не менее белки различных групп иногда довольно сильно отличаются формой своих частиц. Так, у глобулинов пептидные цепи свернуты и молекула имеет форму шара или эллипсоида — глобулы.
Глобулы выдерживают сравнительно энергичные воздействия, не теряя присущей им формы. Белок можно, например, растворить в водном растворе соли, добавить к раствору избыток сульфата аммония, добиться этим приемом осаждения (высаливания) белка и все же глобулы сохраняют свою форму.
Спиральная конфигурация и для α— и для β-спиралей поддерживается за счет водородных связей между группами >СО и NH соседних остатков аминокислот, а также за счет связей между атомами серы аминокислот (дисульфидные связи).
Равновесие 2RSH+1/2О2⇄RS + H2О сильно сдвинуто вправо, если раствор нейтрален, или содержит небольшие количества щелочей; в кислых растворах, наоборот, устойчивы сульфгидрильные группы SH. Связи —S—S— могут быть внутримолекулярными или связывать мономерные единицы белка (например, сывороточный альбумин) в одну крупную частицу. В стабилизации формы молекулы играют роль и гидрофобные связи.
Гидрофобные связи возникают за счет сил взаимодействия между углеводородными частями молекул белка. Углеводородные группы белковых частиц, находящихся в водной среде, ориентированы во внутренние зоны частицы, а гидрофильные группы (ОН, СООН) находятся на внешней стороне, которая обращена к воде. Вследствие этого внутри молекулы белка возникает углеводородное ядро, причем для того, чтобы его разрушить и перевести углеводородные группы в водную среду, надо совершить работу.
Это и означает, что между углеводородными частями молекулы действуют силы притяжения. Кроме водородных, дисульфидных и гидрофобных связей, в поддержании формы молекулы белка принимают участие и другие факторы: имеет значение возникновение солевых мостиков, действие сил Ван-дер-Ваальса; особенно большое влияние оказывают молекулы воды.
Сохранение определенной формы молекулы важно с биологической точки зрения. Оно обеспечивает, в частности, такое взаимное расположение групп атомов на поверхности молекулы, которое необходимо для проявления каталитической активности белка, его гормональных функций и т. д. Поэтому устойчивость глобул, так же как и многие особенности структур биологически активных молекул, не случайное свойство, а одно из средств стабилизации организма.
Растворы белков

Изменяя концентрации солей и варьируя другие факторы, можно осадить из смеси какой-либо определенный белок. В качестве соли оказалось удобным применять сульфат аммония. Выделение белка из раствора в результате повышения концентрации соли лежит в основе одного из методов разделения белков— метода высасывания. При доведении концентрации сульфата аммония до 50% осаждаются глобулины, альбулины выпадают лишь из насыщенного раствора.
Рис. 4. Стабилизирующее действие молекулы воды.
Молекулы воды изображены в виде больших шаров. Внутренняя спираль — пол и пептидная цепь молекулы белка с боковыми ответвлениями.
Взаимодействие белка с молекулами воды приводит к ряду своеобразных явлений. Гидратированные молекулы белка при определенных условиях способны образовывать студнеобразные массы — гели. Примером гелеобразной системы может служить система вода — желатина. При охлаждении 5-процентный раствор желатины застывает, образуется плотная эластичная масса, имеющая сеточную структуру, в полостях которой задерживается большое количество воды.
Часть ее, несомненно, связана химически с белком. По-видимому, молекулы воды присоединяются к его ионным или полярным группам, возможно также присоединение к пептидным группам СО—NH. В настоящее время считают, что молекулы воды, содержащиеся в клетке, связывая между собой отдельные цепеобразные молекулы белка, выполняют роль стабилизатора формы белковой молекулы, окружая ее со всех сторон и препятствуя случайным изменениям конформации (рис. 4). Как и у аминокислот, растворимость белков минимальна в изоэлектрической точке.
Белки в растворе повышают диэлектрическую проницаемость воды. Мерой этого эффекта служит диэлектрический инкремент, т. с. отношение разности диэлектрических проницаемостей раствора и воды к молярной концентрации белка.
Предполагается, что причиной повышенных значений диэлектрической проницаемости белковых растворов является ориентация молекул воды около молекулы белка так, что получается структура, похожая на структуру льда. Другое объяснение основано на предположении, что протоны в группах NH2 и СООН свободно перемещаются между этими группами и не фиксированы прочно.
Знакомое всем явление свертывания белка, например при варке куриных яиц, па самом деле представляет очень сложный процесс. В этом процессе изменяются пептидные цени, сначала они развертываются, а затем снова (но уже иначе) свертываются так, что в итоге изменяется конформация белковой молекулы. Иногда после развертывания цепи так и остаются в развернутом состоянии. Белки с такими же цепями проявляют повышенную химическую активность, так развертывание открывает многие химически активные группы, «прятавшиеся» в глубинах огромной и плотно свернутой белковой спирали.
Денатурация может быть вызвана не только нагреванием, но также и действием кислот, щелочей или концентрированных растворов мочевины. И некоторых случаях изменение условии может вызвать обратный процесс — ренатурацию, когда белок возвращается к прежнему состоянию.
Электронные свойства белков
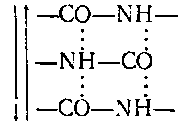
Приближенная оценка величины интервала между этими зонами показала, что он равен 0,25 эв. Более точный расчет привел к еще большей величине, равной приблизительно 1 эв. С этой точки зрения белок должен быть изолятором.
Для выполнения разнообразных жизненных функций отдельные электронные системы веществ клетки не должны быть связаны электронными проводниками. Важнейшая задача согласования и регулирования работы ферментов, переносчиков и более сложных компонентов клетки требует, чтобы, помимо проводников, существовали и изоляторы, позволяющие некоторой части молекулы сохранять заданные состояния и допускающие иные возможности воздействия, кроме электронных (например, механическую деформацию молекулы пли перенос групп атомов).
Классификация белков
Белки, которые растворимы в 50-процентном растворе сульфата аммония, относят к альбуминам; те белки, которые выпадают в осадок при доведении концентрации сульфата аммония до 50% от насыщения, называют глобулинами. Глобулины в свою очередь делят на нерастворимые в чистой воде эуглобулины и растворимые в воде псевдоглобулины.
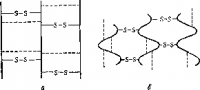
Рис. 6. Структура кератина (по Гауровитцу).
а — вытянутые цепи связаны дисульфидными мостиками и связями иных типов (водородные солевые и другие), отмеченными пунктиром; б — кератин в состоянии сверхсокращения.
Некоторые авторы (Гауровиц) предпочитают рассматривать белки соответственно тем функциям, которые они выполняют в организмах. Несмотря на то что часто один и тот же белок выполняет различные функции — имеет несколько «специальностей», такой принцип классификации кажется более логичным.
К первой группе по этой классификации относят белки плазмы крови, молока, яиц, семян, альбумины, протамины, содержащиеся в рыбах (основные белки), и гистоны, входящие в состав ядер клеток.
Ко второй группе относят структурные белки, образующие соединительную ткань, мышцы, эпидермис. Они выполняют роль каркаса для клеточных и надклеточных структур. Этим белкам свойственны отнюдь не только механические функции, но все же механическая роль для них специфична.
Третью группу образуют комплексы белков с другими веществами (например, гемоглобин — комплекс белка глобина с гемом, представляющим собой соединение железа)—сложные белки.
Четвертая группа объединяет белки-ферменты и пятая — белки-гормоны. Различие между третьей и четвертой группой очень условно, так как, с одной стороны, многие ферменты являются именно сложными белками, а с другой — каталитическая активность настолько часто встречается среди белков, что некоторые биохимики вообще считают любой белок катализатором. Мы рассмотрим свойства лишь отдельных типичных представителей названных групп белков.
Волокнистые, фибриллярные белки, называемые коллагенами, составляют основу органической части костной ткани, тканей хрящей и сухожилий. Коллагены нерастворимы в воде, и лишь некоторые из них удается перевести в раствор. В молекуле коллагена много остатков глицина и иролина и, кроме того, имеется еще аминокислота оксипролин, не встречающаяся в других белках; зато коллаген лишен серу-содержащих аминокислот цистина и цистеина, в нем почти нет и метионина.
Коллаген
Структура молекулы коллагена плохо изучена. Предполагается, что молекула этого белка имеет замкнутую структуру. В волокнах коллагена молекулы белка свернуты в спирали и белковые цепочки идут параллельно друг другу. Волокно коллагена образовано из структурных элементов протофибрилл. В свою очередь, каждая протофибрилла состоит из трех пептидных спиралей, связанных друг с другом водородными и ковалентными связями.
Коллаген, как это часто наблюдается в химии белков, неоднороден; из соединительной ткани можно получить обработкой холодными растворами нейтральных солей растворимый коллаген. Его молекула образована тремя пептидными цепями, две из которых одинаковы; кроме того, был получен кислото-растворимый коллаген и нерастворимая разновидность коллагена. Если коллаген долго нагревать с водой, то некоторые пептидные связи разрушатся, подвергаясь гидролизу, и получится новый белок — желатина смотрим рис 6.
На концах молекулы этого белка можно обнаружить свободные α-аминогруппы, которых нет у коллагена.
Кератин
Рога, волосы, перья содержат другой прочный белок — кератин. В молекуле кератина много поперечных связей дисульфидного характера. Поэтому это очень прочный и нерастворимый белок. Особенно много в нем цистина (из волос человека можно получить кератин с содержанием до 12% цистина).
Если уменьшить число дисульфидных связей, например, путем восстановления (обработка сульфидами) или гидролиза, то растворимость кератина делается уже заметной (продукт восстановления называют кератеином). На этом явлении основано удаление волосяного покрова при обработке кож с помощью различных сульфидов.
Процесс превращения дисульфидных групп в сульфгидрильные обратим, и обработка кератеина окислителями превращает его в исходный продукт — кератин. В кератине, кроме дисульфидных связей, соединяющих вытянутые пептидные цепи, имеются еще и связи других типов (водородные, солевые мостики).
При нагревании в воде шерсти, богатой кератином, до температуры, близкой к температуре кипения, эти менее прочные связи рвутся, и цепи испытывают сокращение в продольном направлении — происходит «сверхсокращение» и обнаруживается тенденция к свертыванию цепей в клубок. Сжатие цепей необратимо и приводит к известному явлению, когда шерстяные вещи садятся при стирке (рис. 6).
К группе структурных белков относится и очень простой по составу белок фиброин шелка (он состоит всего из четырех видов аминокислот: глицина, аланина, тирозина и серина). Почти 60% шелка-сырца представляет собой фиброин. Строение этого белка сходно со строением кератина, хотя в некоторых деталях структуры этих белков отличаются друг от друга.
Все аппараты клеток, поддерживающие ее жизнедеятельность (митохондрии, эндотелиальная сеть и др.), образованы из различных мембран, причем в состав вещества мембраны входят и структурные белки. Несомненно, что их роль не только механическая. Доказано, что структурным белкам присущи и каталитические функции.
Эти функции особенно ярко проявляются у мышечного сократительного белка миозина. Исследования В. В. Энгельгарта и М. Н. Любимовой показали, что миозин ускоряет взаимодействие с водой (т. е. гидролиз) важнейшего аккумулятора энергии — аденозинтрифосфорной кислоты (АТФ). При этом получается аденозиндифосфорная кислота и фосфат. Энергия реакции используется мышцей, во время работы которой нити белка миозина сокращаются.
Следовательно, этот белок выполняет двойную нагрузку: он регулирует освобождение энергии и он же потребляет энергию, сокращаясь в процессе работы мышцы. Молекула миозина представляет собой длинную цепь — ее длина равна примерно 160 нм, а молекулярная масса достигает 600 000. Кроме миозина, известны и другие мышечные белки (актин, тропомизоин). Для того чтобы эти белки могли осуществлять обратимое сокращение, необходимо присутствие катионов металлов, вообще активно поглощаемых мышечными белками.
Для работы мышцы требуются ионы калия, кальция, магния, нужен также запас фосфатов, используемых для синтеза АТФ. Связывание ионов металлов и водорода с ионными группами белков сильно влияет на взаимодействие участков цепи и приводит к изменению ее длины.
Однако механизм мышечного сокращения более сложен и, по-видимому, связан с особым расположением нитей миозина и актина в мышце, позволяющих частицам актина при работе мышцы скользить вдоль нитей миозина. Из числа растворимых белков особенно важны альбумины и глобулины.
Альбумины растворимы в воде и в полунасыщенном растворе сульфата аммония. Молекулы этих белков представляют собой свернутые пептидные цепи, так что форма частиц белка близка к шарообразной или элипсоидной (глобулярные белки).
Альбумины, получаемые из различных частей организма (сыворотка крови, куриные яйца, молоко и т. д.), неоднородны; их обычно удается разделить па 2—3 разновидности. Альбумин можно получить и в виде кристаллов. В молекуле альбумина много серу-содержащих аминокислот, но очень мало глицина.
Характерной чертой сывороточного альбумина является наличие в его молекуле положительно заряженных групп; это приводит к активному поглощению им анионов жирных кислот, ионов хлора и др. В тканях организма альбумин связан с липидами и другими биологически активными веществами. Сывороточный альбумин составляет около 50% всего белка плазмы крови человека (всего и плазме около 7% белков).
В сыворотке крови содержатся и другие растворимые белки— глобулины. Глобулины и образуют вторую половину белков плазмы крови; 15% приходится на α-глобулин, 19% на β- и 11% на γ-глобулип. Все эти белки осаждаются при различных концентрациях сульфата аммония: α-глобулин осаждается при концентрации 2,05 м/л, β-глобулины — при 1,64 м/л и γ-глобулины при 1,34 м/л. 13 α-глобулинах содержатся белки, связанные углеводами и липидами, β-фракция неоднородна — в нее входят белки, содержащие железо и медь (транс-ферритин и церулоплазмин). γ-глобулины также представляют собой смесь белков. Белки этой фракции играют важную роль в развитии иммунитета; антитела представляют собой γ-глобулины.
К глобулинам относится и фибриноген, молекулы которого состоят из трех шаровидных частиц, соединенных пептидными нитями. При свертывании крови в результате сложного процесса фибриноген превращается в фибрин, состоящий из длинных нитей. Свертываясь, эти нити образуют сгусток, останавливающий кровотечение. В превращении фибриногена в фибрин принимает участие другой белок, являющийся ферментом и носящий название тромбина. Тромбин в свою очередь получается из глобулинового белка протромбина, причем для протекания этого процесса требуется присутствие ионов кальция.
Интересен белок, содержащий фосфор,— казеин. В молекуле казеина остатки фосфорной кислоты связаны главным образом с серином. Казеин получается из молока и не является однородным веществом. При осаждении растворами кислот удается получить три фракции: α-, β-, γ-казеин, отличающиеся аминокислотным составом и, вероятно, тоже неоднородные. Казеин можно растворить в щелочах. Из этого раствора обработкой формальдегидом получают пластический материал, пригодный для изготовления волокон, а также для конструкционных целей.
Из молока были выделены также лактоальбумины и лактоглобулины — белки, имеющие небольшую молекулярную массу (16 300 и 38 000) и отличающиеся по составу от альбумина сыворотки и составных частей казеина. Лактоглобулин, по-видимому, состоит из двух белков.
Сильно основные белки (протамины) получены из рыб — эти белки имеют очень низкую молекулярную массу и содержат много аргинина. Менее основные белки — гистоны входят в состав клеточных ядер, они связаны с дезоксирибонуклеиновой кислотой.
Сложные белки
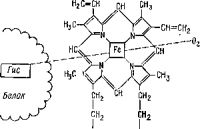
Важнейшим представителем веществ этого типа является переносчик кислорода — гемоглобин. Большое число металлсодержащих белков играет роль ферментов или веществ, связывающих группы различных ферментов (цитохромы). К сложным белкам относят также соединения белков с липидами (липопротеиды), некоторыми углеводами, иодированными аминокислотами (тиреоглобулин) и нуклеиновыми кислотами (нуклеопротеиды).
Рис. 7. Схема строения гемоглобина и ферропротолорфирина.
Комплексное соединение железа, являющееся активной группой гемоглобина, каталазы, миоглобина и цитихрома.
Значение нуклеопротеидов исключительно велико, так как они выполняют ответственные функции в процессах синтеза белка.
Вопрос о прочности связи небелковой группы с основным белковым компонентом отнюдь не прост; иногда небелковая часть прочно удерживается па белке и лишь с большим трудом удается ее отделить, а иногда разделение происходит очень легко.
Примером прочной связи небелковой группы с белком может служить гемоглобин, в котором железо трудно отделить от белка; примером слабой связи — ферменты группы дегидрогеназ. Достаточно простого растворения дегидрогеназы в воде, чтобы она частично диссоциировала на белок и активную небелковую группу.
Гемоглобин представляет собой соединение белка глобина с комплексом железа — гемом. Функции этого сложного белка заключаются в переносе кислорода. Кислород под тем парциальным давлением, которое существует в воздухе и в легочных альвеолах, связывается с гемоглобином, а при пониженном давлении в дышащих тканях отщепляется.
Железо содержится в гемоглобине в виде комплексного соединения — гема, в котором нон железа (II) соединен с протоперфириновой группой (рис. 7). Пятиугольники на рисунке представляют пиррольные ядра с различными заместителями. Все ядра соединены друг с другом метиновыми мостиками — группами СН. Два ядра являются такими производными пиролла, в которых один атом водорода замещен на группу СН3, а другой — на остаток пропионовой кислоты, а два других содержат группу винила —СН = СН2.
Гемоглобин действует как обратимый переносчик кислорода. Молекула его состоит из четырех менее крупных частиц —субъединиц.
В мышцах имеется белок — миоглобин, строение его молекулы очень похоже на строение субъединицы гемоглобина, оба белка сходны и по свойствам. Молекула гемоглобина образована двумя парами пептидных цепей, расположенных так, что получается структура, близкая к тетраэдрической; в целом частица гемоглобина очень компактна. Пептидные цепи в гемоглобине не вполне тождественны: две из них имеют по 146 аминокислот и две по 141.
В каждой такой частице находится четыре атома железа. В координационной сфере комплекса вокруг иона железа всего шесть мест: четыре заняты атомами азота пиррольных ядер, одно частью молекулы белка-глобина (по-видимому, в этом месте находится аминокислотный остаток гистидина), а шестое занято молекулой воды. Вот именно эту воду и вытесняет молекула кислорода, с которой соединяется гемоглобин в альвеолах легких.
Превращения, происходящие в молекуле гемоглобина в результате присоединения кислорода, затрагивают не только железо, но всю молекулу белка. Между четырьмя субъединицами гемоглобина существует взаимодействие. Присоединение молекулы кислорода к одной такой единице увеличивает сродство к кислороду у трех остальных. При этом изменяется конформация белка и даже форма, в которой он кристаллизуется. Гемоглобин лошади кристаллизуется в шестиугольных пластинках, а оксигемоглобин образует игольчатые кристаллы.
Гем и глобин взаимно стабилизированы. Гем без глобина почти мгновенно окисляется кислородом, глобин без гема легко подвергается денатурации. Присоединение кислорода изменяет характер связей — связи из чисто ионных превращаются в ковалентные. Оксигемоглобин в отличие от пара-магнитного гемоглобина является диамагнитным веществом.
Электроны в молекуле гема обладают значительной свободой движения, дело в том, что часть электронов металла и π-электроны порфиринового кольца образуют общую сопряженную систему π-электронов. Кольцо включает 24 молекулярные орбитали и 26 электронов; у комплексов, содержащих ион железа, имеется 25 орбиталей и 26 электронов; π-система у ковалентных феррокомплексов имеет 27 орбиталей и 30 электронов (по Пюльман). По-видимому, в ионных комплексах атом железа оттягивает па себя часть общих π-электропов, а в кова-лентных комплексах, наоборот, атом железа отдает часть своих р-электронов кольцу. Молекула гема, следовательно, представляет собой единую электронную систему.
Замена белка смесью аминокислот
Так как белки под влиянием протеолитических ферментов расщепляются в желудочно-кишечном тракте до аминокислот, то естественно возникает вопрос, нельзя ли заменить белок искусственно приготовленной смесью аминокислот? Такая замена вполне возможна. Если сбалансировать смесь, введя в нее аминокислоты в оптимальном соотношении, то можно получить продукт, пригодный для питания и заменяющий естественные белки.
Разумеется, к такой пище необходимо добавить витамины, жиры, углеводы, но это касается в равной мере и белковой пищи из естественных продуктов. Питательная ценность растительных белков может быть повышена, если добавить к ней чистые аминокислоты из числа тех, которых мало в природном растительном белке.
Смеси аминокислот хорошо зарекомендовали себя при лечении ряда заболеваний; некоторые аминокислоты обладают специфическими свойствами. Так, метионин и лейцин усиливают сердечные сокращения, а аспарагиновая и глутаминовая кислоты оказывают обратное действие. Психические расстройства, вызываемые нарушением правильного соотношения аминокислот в пище, излечиваются при восстановлении баланса аминокислот.
Смеси аминокислот могут служить как концентрированный продукт питания.
В состав одной из исследованных смесей входят 16 аминокислот: аланин, аргинин, аспарагииовая кислота, глутаминовая кислота, глицин, гистидин, лейцин, изолейцин, лизин, метионин, фенилаланин, пролив, серии, треонин, тирозин и валин.
В 1965 г. были опубликованы результаты опытов, проведенных с целью выяснения возможности полной замены естественного белка смесью аминокислот. В течение 19 недель 24 человека получали только синтетическую пищу, в состав которой входили углеводы (глюкоза в количестве 550 г в день и небольшое количество глюконалактона), аминокислоты (19 кислот в количествах от 0,75 до 10,33 г в день), витамины (20 витаминов, в том числе аминобензойная кислота и холин в сравнительно больших количествах: 0,416 г и 0,213 г в день), микроэлементы (соли марганца, меди, кобальта, цинка, молибдат аммония), соли калия, натрия, железа, кальция и оксид магния (II).
Все 24 человека хорошо перенесли пребывание на такой необычной диете; во всяком случае, баланс азота у них был положительный (т. е. они получали азота больше, чем теряли его с продуктами выделения). Разумеется, на основании этого опыта еще нельзя делать выводов о возможности полной замены естественной пищи искусственными, смесями, опыт был слишком кратковременным, по эти исследования, несомненно, открывают интересные перспективы.
Получение белков
Данные о строении полипептидных цепей различных белков позволяют поставить и вопрос об искусственном воспроизведении той последовательности аминокислотных остатков, которая характерна для данного белка, т. е. о синтезе белка.
Еще не так давно эта задача казалась почти неразрешимой: необходимость соединять сотни аминокислот, помещая их остатки в строго установленном порядке требовала усилий многих исследователей и большой затраты времени. Принципиальных трудностей, однако, в этой проблеме не было, и химические методы позволяли сравнительно легко получать низкомолекулярные пептиды.
В настоящее время в этой области достигнуты большие успехи. Уже в 1953 г. удалось получить пептиды, состоящие из девяти аминокислотных остатков и проявляющие те же свойства (гормональные), что и природные соединения (окситоцин и вазопрессин); далее были синтезированы пептиды с 24 и 39 остатками,, затем удалось создать и полипептидные цепочки белка инсулина.
В приборе, названном «синтезатором», Меррифилд с сотрудниками получил полипептиды, закрепив исходную аминокислоту одним концом (группой СООН) на поверхности частицы смолы.
Следующая аминокислота под влиянием водоотнимающего вещества, вступала в конденсацию с закрепленной, так что между ними образовывалась пептидная связь —СО—NH—. Аминогруппа добавленной кислоты во избежание побочных реакций предварительно «защищалась» присоединением к ней вещества, которое впоследствии легко можно было удалить.
Далее процесс повторялся: к закрепленной частице, состоящей теперь уже из двух остатков, снова добавляли «защищенную» аминокислоту и таким образом наращивали цепь аминокислотных остатков еще на одно звено. Все операции установка производила автоматически. Этой машине потребовалось 19 дней для того, чтобы синтезировать белковые цепи (две) инсулина. В одной из цепей находится 21, а в другой 30 аминокислотных остатков.
Позже был получен белок, молекула которого состояла из 124 остатков аминокислот. Синтезы белка в настоящее время успешно выполняются во многих странах. Не следует думать, что выдающиеся достижения — определение последовательности аминокислотных остатков в полипептидной цепи белка и его последующий синтез — означают решение проблемы происхождения жизни; проблема эта по-прежнему остается во многом загадочной, но несомненно, что целенаправленные синтезы столь больших и сложных частиц открывают новые возможности ее экспериментального и теоретического изучения.
Статья на тему Белки

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.