Галогены это простые химические вещества, составляют группу, в которую входят фтор, хлор, бром, иод и астат, формула галогенов F, Cl, Br, I и At.
Каждый из этих элементов имеет на один электрон меньше, чем соседний инертный газ.
Эти элементы называются галогенами или старое название галоидами.

Что такое галогены
Элементы фтор F, хлор Cl, бром Br, йод I и астат At, химические элементы 17-й группы периодической таблицы химических элементов Д. И. Менделеева, (устаревшая классификация: в VIIA-группу) , называют галогенами, что по-гречески означает «солерождающие».
Это название они получили за свойство непосредственно соединяться с металлами и образовывать типичные соли — галиды (фториды, хлориды, бромиды, иодиды).
Встречающееся еще старое название этих элементов — «галоиды» означает «похожие на соль» и поэтому неправильно.
Атомы галогенов имеют по семь электронов на внешнем уровне s²p⁵. До завершения оболочки инертных элементов им недостает только одного электрона (как и в атоме водорода).
Поэтому галогены сильнейшие окислители. Обладая большим сродством к электрону , атомы их легко превращаются в отрицательные ионы Э — с электронной структурой s²p⁶.
Следовательно, галогены это типичные неметаллы.
Но от фтора к астату по мере увеличения радиусов атомов электро-отрицательность галогенов уменьшается, окислительная активность нейтральных атомов ослабевает:
F > Cl > Br > I > At.
У йода и астата появляются металлические признаки. Вследствие различия окислительных активностей одни галогены вытесняют другие из соединений с металлами или с водородом.
При этом фтор вытесняет все остальные галогены, хлор вытесняет бром, йод и астат, бром может вытеснять йод и астат и т. д.
Вместе с тем галогены заметно отличаются между собой по свойствам, так как прежде всего различны их атомные радиусы. Наименьший атомный радиус имеет фтор, наибольший — астат.
В результате этого (и других причин) фтор обладает наибольшим сродством к электрону и является самым сильным окислителем из простых веществ и соединений.
От фтора к астату окислительная способность падает. Одновременно в указанном направлении возрастают металлические свойства элемента.
В то время как фтор, хлор и бром их не проявляют, у йода, и в особенности у астата, они довольно заметны . Фтор настолько сильный окислитель, что он окисляет даже кислород.
В атмосфере фтора горят такие стойкие вещества, как стекло (в виде стеклянной ваты), вода.
Указанные процессы можно выразить следующими уравнениями реакций:
SiO2 + F2 = SiF4 + O2
H2O + F2 = 4HF + O2
При анализе представленной в уравнениях степени окисления элементов видно, что кислород окисляется, а фтор восстанавливается.
Если над нагретой водой пропускать фтор, то вода буквально горит, а продуктом горения является кислород.
Для йода известны соединения, в которых он выступает как элемент с положительной степенью окисления, например хлорид:
(III) (ICl3) , ацетат иода (III) (CH3COO)3I и др.
Необходимо отметить, что в последнее время резко возросло практическое значение фторорганических соединений.
В свободном состоянии галогены в природе не встречаются.
Физические свойства галогенов
В элементарном состоянии галогены образуют устойчивые двухатомные молекулы. Их устойчивость подтверждается тем фактом, что молекулы галогенов расщепляются на атомы только при очень высоких температурах.
Известно, например, что хлор вблизи поверхности Солнца при температуре около 6000° С существует в атомарном состоянии.
При более низких температурах атомы хлора соединяются, образуя молекулы:
2Cl (г) → Cl2 (г) (11)
Дальнейшего взаимодействия между молекулами хлора не наблюдается.
По-видимому, двухатомные молекулы галогенов уже обладают устойчивой электронной конфигурацией инертного газа. Как это происходит?
Как может один атом хлора удовлетворить свою потребность еще в одном электроне (т. е. как он приобретает устойчивую конфигурацию аргона) за счет соединения с таким же атомом хлора?
На этот вопрос можно ответить, если предположить, что два атома, входящие в состав молекулы хлора, имеют обобщенные два электрона.
Если два атома располагаются близко друг к другу и между ними находится обобщенная пара электронов, то каждый из атомов ведет себя так, как если бы он имел высокую устойчивость инертного газа.
В результате из атомов хлора образуется устойчивая молекула Сl2. Таким же образом можно объяснить образование двухатомных молекул других галогенов.
Поскольку в каждой из этих молекул атомы связаны между собой обобщенной парой электронов, такая связь называется ковалентной связью.
Таблица свойств галогенов
| Свойство | Фтор | Хлор | Бром | Йод | Астат |
| Порядковый номер | 9 | 17 | 35 | 53 | 85 |
| Атомный вес | 19,0 | 35,5 | 79,9 | 127 | |
| Молекулярная формула | F2 | Cl2 | Вr2 | J2 | |
| Температура кипения °К | 85 | 238,9 | 331,8 | 457 | |
| Температура кипения °С | —188 | —34,1 | 58.8 | 184 | |
| Температура плавления °К | 55 | 172 | 265,7 | 387 | |
| Температура плавления °С | —218 | —101 | —7.3 | 114 | |
| Атомный объем в твердом состоянии, см3/моль атомов | 14.6 | 18,7 | 23,5 | 25,7 |
Температура кипения и температура плавления
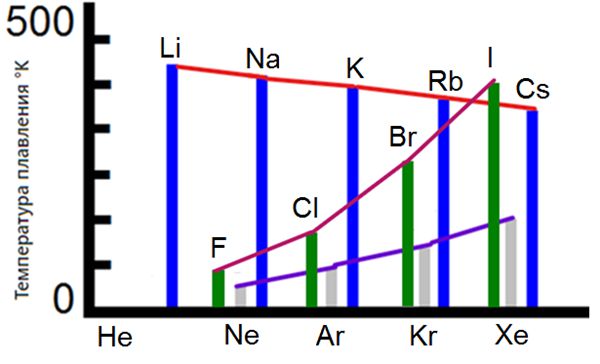
После образования двухатомных молекул способность атомов галогенов к взаимо-связыванию «исчерпывается».
Остаточные силы притяжения, действующие между двумя такими двухатомными молекулами, отчасти обусловливают сжижение инертных газов.
Действительно, температуры плавления галогенов возрастают с увеличением порядкового номера (вспомните, что для щелочных металлов наблюдается обратная зависимость) и в жидком состоянии они устойчивы лишь в узком интервале температур.
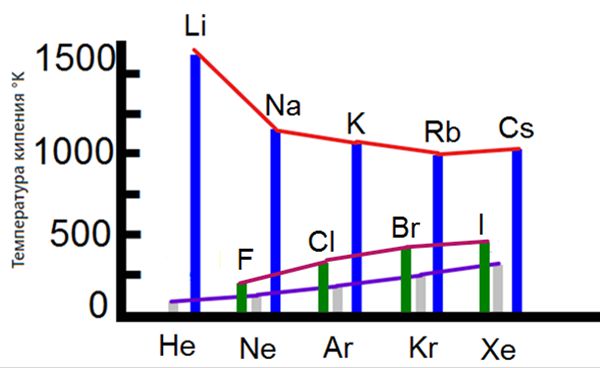
Фтор и хлор при нормальных условиях представляют собой газы, бром — жидкость, иод — твердое вещество.
Различия в физическом состоянии связаны с «нормальными условиями», которые не везде одинаковы.
Так, на планете с «нормальной» температурой 25° К все галогены находились бы в твердом состоянии, в то время как неон представлял бы собой жидкость, гелий — газ, а аргон, криптон и ксенон —твердые вещества.
Химические свойства галогенов
Взаимодействие галогенов с одним из щелочных металлов, например натрием, свидетельствует о том, что они имеют общие свойства.
Между галогенами и металлическим натрием происходят следующие реакции:
Na (тв) + 1/2 F2 (г) → NaF (тв) + Тепло (12)
Na (тв) + 1/2 Сl2 (г) → NaCl (тв) + Тепло (13)
Na (тв) + 1/2 Вr2 (г) → NaBr (тв) + Тепло (14)
Na (тв) + 1/2 I2 (г) → Nal (тв) + Тепло (15)
Все эти реакции протекают очень легко и приводят к образованию ионных твердых веществ с общей формулой NaX.
Кристаллическая решетка каждого из этих веществ состоит из положительно заряженных атомов натрия и отрицательно заряженных атомов галогена.
Отрицательные ионы F—, Сl—, Вr— и I— называются галоген-ионами. Устойчивость этих ионов можно связать с устойчивостью электронной конфигурации соответствующего инертного газа.
Галогены взаимодействуют также с водородом с образованием галогеноводородов:
Н2 (г) + F2 (г) → 2HF (г) Фтористый водород (16)
Н2 (г) + Cl2 (г) → 2НСl (г) Хлористый водород (17)
Н2 (г) + Вr2 (г) → 2НВr (г) Бромистый водород (18)
Н2 (г) + I2 (г) → 2HI (г) Йодистый водород (19)
Ни одна из этих реакций не протекает легко при комнатной температуре. Это происходит потому, что сначала должны разорваться связи, удерживающие атомы в молекулах водорода и галогена, а затем образуются новые связи между атомами водорода и атомами галогена.
Разрыву связей способствует высокая температура, и начавшись эти реакции протекают быстро, а иногда даже со взрывом.
Химия галоген-ионов
Большинство элементов образует устойчивые галогениды. Так, кальций образует соединения CaF2, СаСl2, СаВr2 и СаI2 — все ионного строения.
В кристаллах этих соединений ион кальция несет заряд 2+, а галоген-ионы — заряд 1—. Галогениды кальция имеют эмпирическую формулу СаХ2.
Галогениды (галоидные соли) щелочных металлов — относительно инертные соединения. Они хорошо растворяются в воде и очень плохо — в спирте.
Хлористое серебро имеет малую растворимость в воде. Так же растворяются бромистое серебро и йодистое серебро.
На малой растворимости этих соединений основано определение хлор-, бром-и иод-ионов, присутствующих в водных растворах.
Если к раствору, содержащему иод-ионы I—, прилить раствор азотнокислого (нитрата) серебра, содержащий ионы серебра Ag+ и нитрат-ионы NO3, то образуется желтый осадок йодистого серебра:
Ag+ (водн) + I— (водн) → Agl Желтый осадок (20)
В присутствии бром- или хлор-ионов протекают следующие реакции:
Ag+ (водн) + Вr— (водн) → AgBr Светло-желтый осадок (21)
Ag+ (водн) + Cl— (водн) → AgCl Белый осадок (22)
Фтористое серебро растворяется в воде. Поэтому при добавлении ионов Ag+ к раствору фтор-ионов осадок фтористого серебра не образуется.
Водородные соединения галогенов (галогеноводороды)
Почти все галогеноводороды при комнатной температуре существуют в газообразном состоянии.
Исключение составляет фтористый водород, который переходит в жидкое состояние при 19,9° С и давлении 1 атм. Наиболее важна химия водных растворов галогеноводородов.
Летучие водородные соединения галогенов (галоводороды) НЭ хорошо растворимы в воде. В водных растворах они ведут себя как кислоты.
Сила (степень диссоциации) галоводородных кислот растет по мере уменьшения электроотрицательности ионов (сверху вниз).
Объясняется это общим уменьшением прочности связи Н—Э в молекулах галоводородов от фтора к астату.
Молекулы наиболее слабой фтороводородной кислоты склонны к ассоциации , поэтому для нее известны кислые соли.
Фтор , обладает самой высокой электроотрицательностью , во всех соединениях имеет степень окисления +1 до +7.
Кислородные соединения галогенов нестойки и получаются косвенными способами.
В противоположность галоводородам, прочность кислородных соединений галогенов растет в ряду фтор — астат; наиболее прочны кислородные соединения йода и астата.
Водород, являющийся s-элементом, в различных вариантах периодической системы помещают то вместе со щелочными металлами, то с галогенами, а иногда даже рассматривают отдельно.
Действительно, он сходен со щелочными металлами, так как образует положительный ион Н⁺ и играет роль восстановителя в реакциях.
Сродство к электрону и электроотрицательность у водорода меньше, чем у галогенов . Тем не менее водород имеет гораздо больше сходства с галогенами, чем со щелочными металлами.
В гидридах активных металлов (NaH, СаН2) содержится ион Н⁺, подобный ионам Г- в галидах (NaCl, СаСI2).
Молекулы водорода и галогенов двухатомны. Для водорода, как для фтора или хлора, характерны газообразное состояние и неметаллические свойства.
Первые потенциалы ионизации водорода и галогенов довольно близки. Атомы водорода легко замещают атомами галогенов в органических соединениях.
Кроме того, водород имеет ряд индивидуальных особенностей, связанных с тем, что его валентный электрон находится непосредственно в сфере действия атомного ядра (без промежуточного электронного слоя).
Например, протон не образует соединений с ионной связью. Особенностями строения атома водорода обусловлено также существование водородной связи.
Галогеноводороды и вода
Все галогеноводороды растворяются в воде с образованием водных растворов, проводящих электрический ток, что свидетельствует о присутствии в растворе ионов.
Реакции можно записать следующим образом:
HF (г) + Н2О → Н+ (водн) + F— (водн) (23)
НСl (г) + Н2О → Н+ (водн) + Сl— (водн) (24)
НВr (г) + Н2О → Н+ (водн) + Вr— (водн) (25)
HI (г) + Н2О → Н+ (водн) + I— (водн) (26)
Эти растворы, имеющие сходные свойства, называются растворами кислот.
Во всех растворах присутствуют ионы Н+, которые и придают особый характер водным растворам кислот.
Атомные объемы галогенов
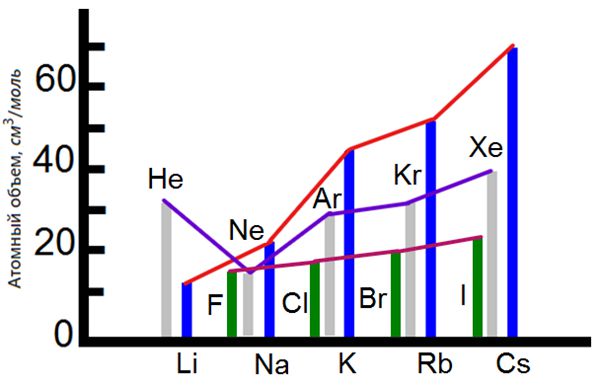
Продолжим рассмотрение свойств инертных газов и щелочных металлов. Сравним атомные объемы трех соседних элементов в твердом состоянии:
| Фтор | Неон | Натрий |
| 14.6 см3 | 20,2 см3 | 23,7 см3 |
| Хлор | Аргон | Калий |
| 18.7 см3 | 24,2 см3 | 45,4 см3 |
| Бром | Криптон | Рубидий |
| 23,5см3 | 41,9 см3 | 55,8 см3 |
Атомный объем увеличивается в ряду галоген — инертный газ — щелочной металл.
Быстрые ответы?
Это простые химические вещества, составляют группу, в которую входят фтор, хлор, бром, иод и астат, формула галогенов F, Cl, Br, I и At.
В элементарном состоянии галогены образуют устойчивые двухатомные молекулы. Их устойчивость подтверждается тем фактом, что молекулы галогенов расщепляются на атомы только при очень высоких температурах.
Галогены очень реакционно способные вещества, например в атмосфере фтора начинает гореть вода.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.