Электроэкстракция цинка
Цинк применяется для производства сплавов, для защитного покрытия изделий из железа, для производства красок и. пр.
В настоящее время получение цинка используют почти исключительно сульфидные руды. Главным цинковым минералом в них является сфалерит ZnS (цинковая обманка).
Сульфидные цинковые руды обычно содержат и другие цветные металлы (полиметаллические руды, содержащие цинк, свинец, кадмий, медь, благородные металлы и пр.).
Флотацией полиметаллических руд можно получить селективные сульфидные концентраты, содержащие, в основном, только один цветной металл (цинк, свинец или медь). Переработку каждого из них производят отдельно.
Получение цинка из сульфидного концентрата осуществляют двумя способами: пирометаллургическим или гидрометаллургическим (удельный вес этих двух способов в мировом производстве цинка почти одинаковое большее развитие имеет гидрометаллургический способ). Пирометаллургический способ получения цинка состоит из окислительного обжига концентрата и восстановления и дистилляции (возгонки) цинка из полученного огарка. При гидрометаллургическом производстве цинка исходный сульфидный концентрат также подвергается окислительному обжигу. Обожженный концентрат выщелачивают серной кислотой. Затем из раствора удаляют примеси и выделяют цинк электроэкстракцией.
Обжиг цинкового концентрата перед выщелачиванием
Цинковая обманка плохо растворима в серной кислоте. Окись цинка ZnO, напротив, легко растворяется уже в слабых растворах серной кислоты при обычной температуре:
ZnO + H2SО4 → ZnSО4 + н2о
Поэтому перед выщелачиванием серной кислотой необходим окислительный обжиг сульфида цинка. В зависимости от условий обжига возможны следующие реакции:
ZnS + l,5О2 → ZnO + SО2
SO2 + 0,5О2→SO3 ZnO + SO3 → ZnSО4
Обжиг следует вести таким образом, чтобы основная масса цинка была связана в окись, а содержание сульфата цинка в огарке не превышало бы необходимого количества для восполнения потерь SO4 в процессе (около 3% S). Поэтому обжиг ведут при 850—900° С, превышающих температуру сульфатообразования, когда равновесие реакции
ZnO + SО3 ⇄ ZnSО4
сдвинуто в сторону образования ZnO и SO3.
Наряду с сульфидом цинка в концентрате присутствуют различные примеси: сульфиды железа, свинца и меди, окислы железа, кремнезем, глинозем и др. Все они в какой-то степени влияют на процесс обжига. Наибольшее значение имеет окись железа, которая при температуре выше 600° С при соприкосновении с окисью цинка образует феррит цинка:
ZnO + Fe2О3 → ZnO • Fe2О3
Скорость получения цинка этой реакции сильно возрастает с повышением температуры. Феррит цинка представляет собой соединение, плохо растворимое в разбавленной серной кислоте, поэтому образование феррита в ходе обжига приводит к потере цинка при выщелачивании.
Основная реакция обжига протекает с большим выделением тепла, и необходимая температура процесса обеспечивается без подогрева. Газы, получающиеся при обжиге, обычно имеют высокую концентрацию SО2 (5—7% и выше) и служат ценным сырьем для производства серной кислоты. Обжиг цинковых концентратов осуществляется сейчас, в основном, в печах «кипящего» слоя, а также в многоподовых печах.
Выщелачивание огарка цинка
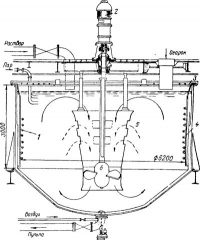
Обожженный концентрат — огарок — подвергается выщелачиванию отработанным электролитом, содержащим обычно 100—150 г/л серной кислоты. Выщелачивание ведут при интенсивном перемешивании в аппаратах-агитаторах. Применяются агитаторы с механическим (рис. 2) или с воздушным перемешиванием. В механических агитаторах перемешивание пульпы осуществляется с помощью пропеллерной мешалки, приводимой в движение электромотором. В воздушных (пневматических) s агитаторах перемешивание производится путем пропускания сжатого воздуха, который движется вверх по вертикальной центральной трубе агитатора, увлекая за собой пульпу. Выщелачивание в пневматических агитаторах способствует окислению тех компонентов раствора, которые могут окисляться растворенным в воде кислородом, в частности, окислению Fe2+ до Fe3+.
1 — трубчатый нагреватель; 2 —привод мешалки; 3— крышка; 4 —корпус; 5— направляющая труба; б —мешалка.
Основной реакцией выщелачивания является реакция растворения окиси цинка. Кроме того, в ходе выщелачивания происходит переход в раствор большого числа примесей, например:
CdO + H2SО4 → CdSО4 + H2О CuO + H2SО4→ CuSО4 + H2О FeO + H2SО4 → FeSО4 + H2О
Некоторые из этих примесей удаляются из раствора при доведении его до почти нейтральной реакции в конце выщелачивания. Возможность одновременной с выщелачиванием очистки раствора от ряда примесей основывается на том, что при нейтрализации раствора соли этих примесей подвергаются гидролизу при более низких значениях рН, чем ZnSО4, и образуют труднорастворимые гидроокиси или основные соли.
Образования гидроокисей для ряда металлов в зависимости от концентрации соли в сульфатном растворе. Раствора ZnSО4 с выпадением основной соли начинается при рН = 5,3, а такие примеси, как окисное железо при этом значении рН уже практически целиком оказываются связанными в труднорастворимые соединения. Сурьма и висмут гидролизуются при еще более низких величинах рН, чем железо. Мышьяк, а также германий, индий и ряд других примесей адсорбируются гидроокисью железа и таким образом выводятся из раствора. Часть железа присутствует в растворе в закисной форме. Его перед осаждением необходимо окислить до трехвалентного. Это удается осуществить с помощью кислорода воздуха, поскольку окислительно-восстановительный потенциал Fe2+/Fe3+ отрицательнее потенциала кислорода (φFe2+/Fe3+ = + 0,77, φ°O2/H2O = + 1,23), и в растворе протекает реакция
4Fe2+ + O2 + 4Н+ → 4Fe3+ + 2Н2O
Для ускорения окисления закисного железа в окисное в агитаторы, где проводится нейтральное выщелачивание и железоочистка, часто добавляют активный окислитель — пиролюзит МnO2.
Для повышения степени извлечения цинка выщелачивание ведут обычно в две стадии. В первой (кислой) стадии практически весь цинк исходной загрузки вместе с примесями растворяется в избытке кислоты, и получаются слабокислые растворы (4—6 г/л H2SO4), которые идут на вторую стадию выщелачивания новой порции огарка, причем остаточная кислота полностью нейтрализуется избытком огарка. Раствор после нейтральной стадии выщелачивания идет на дальнейшую очистку, а частично выщелоченный остаток от нейтрального выщелачивания поступает в кислую стадию в качестве загрузки. Выщелачивание может быть непрерывным и периодическим. Наиболее распространенной является классическая схема непрерывного двухстадийного выщелачивания.
Все операции указанной схемы: подача огарка, сгущение пульп, подача илов (песков) на кислую стадию, циркуляция растворов и прочее осуществляются непрерывно, что обеспечивает полное полезное использование оборудования. Непрерывная схема легко может быть автоматизирована, она требует меньшего количества рабочей силы, чем периодическое выщелачивание.
Схема двухстадийного непрерывного выщелачивания может иметь разные варианты.
Во многих случаях не весь отработанный электролит подают на кислую стадию, большую или меньшую часть его можно направлять на нейтральное выщелачивание. В зависимости от этого изменяется доля цинка, растворяющегося в каждой стадии, и поведение примесей в нейтральном и кислом выщелачивании.
Существенным недостатком схем непрерывного выщелачивания является то, что режим их работы плохо поддается корректировке в случае изменения состава огарка и оборотного раствора. При периодическом выщелачивании можно изменять режим в соответствии с изменением состава сырья. Степень извлечения цинка при периодическом выщелачивании, как правило, более высокая, особенно при низкосортных концентратах.
Пульпа после выщелачивания огарка сгущается в сгустителях типа Дорра; фильтрация в зависимости от состава раствора и содержания в нем твердой фазы (отношение жидкого к твердому Ж: Т) производится на рамных, барабанных или дисковых вакуум-фильтрах, или на фильтрпрессах.
После удаления из нейтрального электролита примесей, дающих труднорастворимые гидроокиси или основные соли, он поступает на очистку от меди и кадмия. Обе эти примеси удаляются из раствора цементацией цинковой пылью:
Cu2++Zn → Cu + Zn2+
Cd2+ +Zn → Cd + Zn2+
Цинк, обладая значительно более электроотрицательным потенциалом, чем медь и кадмий, вытесняет их из раствора весьма полно. На практике процесс ведут таким образом, что дозировкой количества цинковой пыли сначала вытесняют медь, а затем кадмий в отдельный продукт (кадмиевая губка).
После операций цементации электролит направляют на удаление из него кобальта, а иногда и иона хлора. Первый обычно осаждают в виде труднорастворимых соединений — ксантогената кобальта (С2Н5ОСS2)3Со или соли α-нитрозо-β-нафтола (C10H6ONO)3Co, а второй — в виде полухлористой меди.
Удаление свинца из электролита (если растворимость превышает допустимый предел содержания свинца в электролите, необходимый для получения цинка высокой чистоты) можно осуществлять путем соосаждения свинца с труднорастворимым сульфатом стронция SrSO4, в котором свинец изоморфно замещает стронций. Для этого в электролит добавляется карбонат стронция SrCO3.
Статья на тему Получение цинка


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.