Основные методы получения никеля в производстве
Никель является важнейшим металлом для производства нержавеющих сталей, жароупорных сплавов, высоковязких сталей; его широко используют в качестве материала для защитно-декоративных гальванических покрытий, а также для электродов радиоламп и в щелочных аккумуляторах. Мировое производство никеля составляет сейчас около 400 тыс. т в год.
В природе никель встречается в сульфидных медно-никелевых или в никелевых окисленных рудах. Сульфидные руды, содержащие, кроме никеля и меди, еще кобальт, железо и платиновые металлы, сперва подвергают флотационному обогащению (если руды бедные). Затем концентрат или руду подвергают плавке в электрических, отражательных или шахтных печах и получают медно-никелевый штейн (в который переходят платиновые металлы, а также большая часть кобальта) и отвальный шлак. Штейн продувают воздухом в конверторе. Железо, окисляясь при продувке, переходит в шлак, в конверторе же остается расплав, содержащий сульфиды никеля и меди с небольшой примесью железа.
Этот расплав (так называемый файнштейн) после отливки и медленного охлаждения поступает на дробление и флотационное отделение сульфида никеля от сульфида меди. Медный концентрат от флотации файнштейна поступает на извлечение меди, а никелевый подвергается окислительному обжигу в печах «кипящего слоя». Получающийся огарок затем плавят с восстановителем в отражательных или электропечах. Полученный «черновой» никель разливают на аноды, содержащие обычно 88—95% Ni, 1,5—6% Сu, 0,5— 2,5% Fe, 0,5—2% Со, 0,5—2% S, немного кремния, углерода и окислов (железа, никеля и кобальта и др.).
Заключительной операцией переработки сульфидных руд является электролитическое рафинирование, дающее возможность получать никель высокой чистоты и выделять медь, кобальт и платиноиды в самостоятельные полупродукты, подвергающиеся дальнейшему переделу.
Окисленные никелевые руды либо плавят с восстановителем (коксом) в шахтных или электрических печах на ферроникель (сплав железа с никелем) либо, добавляя наряду с восстановителем сульфидизатор (гипс, пирит), ведут плавку на никелевый штейн. Последний состоит, в основном, из сульфидов никеля и железа, а также содержит кобальт. Штейн продувают в конверторах воздухом, окисляя при этом железом и получают никелевый файнштейн, представляющий собой, в основном, сульфид никеля.
Файнштейн после охлаждения и измельчения обжигают в печах «кипящего слоя» и трубчатых печах до получения закиси никеля. Последнюю плавят с восстановителем на металлический никель. Металлический никель либо является готовым продуктом (как правило, он имеет относительно невысокую чистоту), либо из него отливают аноды, идущие на электролитическое рафинирование.
Катодный процесс получения никеля
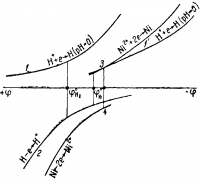
Как видно из рис. 2, в кислых растворах (при рН = 0) и небольших плотностях тока на катоде будет выделяться только водород. При снижении концентрации ионов водорода до рН ≈ —5 перенапряжение при выделении водорода увеличивается, и равновесный потенциал сдвигается настолько, что появляется возможность выделения никеля. С повышением плотности тока доля никеля в совместном разряде будет возрастать.
Рис. 2. Схема поляризационных кривых процесса электролитического рафинирования никеля.
Ввиду того, что с увеличением температуры поляризация при выделении ионов Ni2+ снижается больше, чем при выделении ионов Н+, температурный фактор оказывает очень существенное влияние на соотношение скоростей процессов выделения никеля и водорода. С повышением температуры выход по току никеля возрастает.
Выход по току зависит также от состава электролита. В чисто-сульфатных растворах он ниже, чем в растворах, содержащих ион хлора, причем увеличение концентрации последнего повышает выход по току. Для увеличения выхода по току никеля следует также повышать концентрацию ионов никеля в электролите, что сдвигает равновесный потенциал никелевого электрода в электроположительную сторону и снижает поляризацию.
Несмотря на возможность очень сильного подавления скорости разряда ионов водорода, все же даже в оптимальных условиях этот разряд в некоторой степени имеет место. Выделение водорода приводит к понижению концентрации Н+ в катодном пространстве. Пределом понижения кислотности является то значение рН, которое отвечает началу образования твердой фазы — гидроокиси или основной соли никеля.
Высокий отрицательный потенциал катодного осаждения никеля приводит к тому, что большинство примесей металлов, содержащихся в электролите катодного пространства (католите), осаждается раньше или вместе с никелем, загрязняя осадок.
Вследствие этого при электролизе никеля каждый катод помещают в отдельную ячейку, представляющую собой каркас с натянутой на него фильтрующей тканью (диафрагмой). В ограниченные таким путем катодные пространства непрерывно подается очищенный от примесей электролит. Фильтруясь через диафрагму в анодное пространство, раствор загрязняется там примесями из растворяющегося анода. Вытекающий из ванны загрязненный электролит (анолит) подвергается очистке, после чего вновь подается в катодные ячейки. Уровень католита в катодной ячейке держится на 5—10 смвыше уровня а но лита, обеспечивая определенную скорость протекания раствора через поры диафрагмы, чтобы воспрепятствовать попаданию катионов примесей через диафрагму в катодное пространство. Эта скорость должна превышать скорость движения катионов примесей под действием электрического поля.
После очистки концентрация примесей в электролите невелика, так что многие из них разряжаются на предельном токе в количестве, прямо пропорциональном их концентрации в растворе. При плотности тока 150 —200 а/м2 каждому миллиграмму двухвалентной примеси в катодном пространстве электролита соответствует примерно 0,003—0,004% примеси в катодном осадке. Из этих данных можно рассчитать предельно допустимое содержание примесей (разряжающихся на предельном токе) в электролите при получении катодного никеля той или иной степени чистоты.
Содержание всех примесей в осадке (разряжающихся на предельном токе) с повышением катодной плотности тока снижается примерно обратно пропорционально корню квадратному из плотности тока.
Анодный процесс получения металла
До недавнего времени электролитическое рафинирование никеля производилось с анодами, отлитыми из металлического чернового никеля. В последние годы был применен процесс растворения сульфидных анодов, отлитых из никелевого файнштейна или никелевого концентрата флотации медно-никелевого файнштейна . На отечественных заводах этот новый процесс пока не нашел применения, а за рубежом с сульфидными анодами работают сейчас два крупных завода.
Растворение металлических анодов. Ввиду малого тока обмена ионизация никеля, так же как и разряд, сопровождается значительной поляризацией. Кроме того, никель легко пассивируется, его ионизация при этом прекращается, и на аноде начинает выделяться кислород. Для предотвращения пассивирования при плотностях тока 100—200 а/м2 в электролите обязательно должны быть ионы хлора в количествах не менее 1—2 г/л. Но и при активном состоянии никелевого анода, когда плотность тока достигает 160— 250 а/ж2, анодный потенциал примерно на 0,3—0,5 в электроположительные равновесного потенциала никеля.
Основным анодным процессом является процесс ионизации никеля:
Ni — 2e → Ni2+
Так как этот процесс идет при относительно отрицательных потенциалах, то разряда ионов хлора или восстановления молекул воды с выделением газообразных хлора и кислорода обычно не происходит. Однако большая анодная поляризация приводит к тому, что примеси не только более электроотрицательных, чем никель, металлов, но и некоторых более электроположительных металлов, таких, как медь, переходят с анода в раствор. Таким образом, все основные примеси, содержащиеся в никелевых анодах,— медь, железо, кобальт — оказываются в растворе.
Анодный процесс сопровождается образованием шлама. Количество шлама достигает 2—5% от веса растворившихся анодов. Шлам состоит из содержащихся в анодах сульфидов, окислов, шлаковых и других включений, а также содержит металлы платиновой группы, которые, являясь значительно более электроположительными, чем никель, не растворяются на аноде. В шлам переходит до 1 % от содержания в анодах никеля, кобальта и железа и 5—20% меди. Основными компонентами шлама являются сульфиды этих металлов. При электролизе металлических анодов содержащиеся в них примеси сульфидов почти не растворяются, поэтому переход металлов в шлам и количество последнего резко возрастают с увеличением содержания серы в металлических анодах. На практике стремятся не допускать содержания серы в анодах выше 1 %.
Растворение сульфидных анодов
При содержании серы в никелевых анодах ниже 15—18% сульфид никеля не образует сплошной массы в структуре анода и разделен значительными включениями металлического сплава, пронизывающими тело анода. В этих условиях анодное растворение идет с ионизацией, в основном, металлов, входящих в состав металлического сплава, а не в состав сульфидов, так как этот процесс требует меньшего анодного потенциала, чем растворение сульфидов. Анод в целом ведет себя как металлический, и сульфиды преимущественно переходят в шлам.
При содержании серы свыше 20—23% количество металлического сплава весьма невелико, и он имеет вид небольших включений в сульфидной массе, образующей структуру анода. При этом растворение происходит с ионизацией основной массы сульфида никеля, и такой сульфидный анод растворяется достаточно полно.
Таким образом, при электролитическом рафинировании никеля с сульфидными анодами стремятся иметь высокое содержание серы в анодах, не менее 23—25%.
Ионизация сульфида никеля при анодном растворении сульфидных анодов протекает по реакции
Ni3S2 —6e → 3Ni2++2S
Ионы никеля переходят в раствор, а элементарная сера остается на аноде, образуя пористую, хорошо проводящую ток, корку серного шлама.
Реакция выше протекает при более положительных потенциалах, чем растворение металлического никеля. Анодной плотности тока порядка 170—230 а/м2 отвечает средний потенциал около +1,2—1,5 в, что примерно на 1в превышает потенциал металлического анода. По мере растворения сульфидного анода и увеличения толщины корки серного шлама анодный потенциал постепенно возрастает за счет увеличения концентрационной поляризации, вызванной плохой диффузией электролита в порах шламовой корки. При этом наряду с реакцией становится возможным более глубокое анодное окисление сульфида никеля по суммарной реакции
Ni3S2 + 8Н2О — 18е → 3Ni2+ + 2SO2-4 + 16Н+
Этот процесс, включающий, помимо окисления сульфида, также ионизацию воды, является вредным, так как приводит к снижению анодного выхода по току металла и вызывает повышение концентрации Н+ анолита.
В шлам при электролизе сульфидных анодов, помимо элементарной серы, переходят практически все платиноиды, селен и теллур (в элементарном виде), а также некоторое количество сульфидов, прежде всего сульфид меди, растворение которого при потенциалах никелевого сульфидного анода происходит неполностью. Количество шлама составляет около 25% от веса растворившегося анода.
Электролит для рафинирования никеля
Электролитическое рафинирование никеля возможно как в сульфатном, так и в хлоридном электролите. Раньше, при работе на низких плотностях тока (100—130 а/м2), сульфатный электролит удовлетворял условиям процесса и применялся на всех электролитных заводах. В состав этого электролита, помимо сульфата никеля (100—130 г/л),входили сульфат натрия (40—60 г/л), хлорид натрия (до 3—б г/л) и борная кислота (15—25 г/л). Сульфат натрия применяли для понижения сопротивления раствора, поскольку удельная электропроводность чистого NiSO4 относительно низка (для раствора NiSO4 с содержанием 60 г/л никеля она составляет при 60° С около 0,055 ом-1•см-1). Хлорид натрия добавляли для устранения пассивации анодов. Борная кислота Н3ВО3 способствует получению качественных катодных осадков никеля с гладкой матовой поверхностью, серебристо-белого цвета.
В связи с последующей интенсификацией электролиза, повышением плотности тока (до 170—250 а/м2) удельная электропроводность указанного выше сульфатного раствора (при 60° С она составляет около 0,09 ом-1•см-1)оказалась недостаточной. Для ее увеличения в электролит стали вводить все в больших количествах NaCl. Помимо повышения удельной электропроводности, увеличение содержания иона хлора способствует росту катодного и анодного выходов по току и позволяет иметь меньшие содержания в электролите борной кислоты.
В настоящее время смешанный сульфат-хлоридный электролит, содержащий значительное количество хлорида, применяется повсеместно.
Большое значение для процесса электролиза имеет содержание в растворе никеля. При низкой общей его концентрации обеднение никелем прикатодного слоя может быть значительным, что приводит к получению бракованных губчатых катодных осадков. Низкое содержание никеля в растворе обусловливает также рост катодной поляризации, что увеличивает напряжение на ванне и снижает катодный выход по току за счет более интенсивного выделения водорода. При высоких плотностях тока все указанные явления проявляются особенно резко, поэтому в настоящее время концентрацию никеля в электролите держат близкой к насыщению. Применяющиеся сейчас электролиты содержат обычно 145—200 г/л NiSO4 (55—80 г/л Ni2+), 40—80 г/л Na2SO4, 60—100 г/л NaCl и до 15 г/л Н3ВО3. Удельная электропроводность таких растворов при 60° С лежит в пределах 0,15—0,19 ом-1 • см-1.
Переработка шлама никеля
Шламы электролитического рафинирования никеля являются одним из основных источников получения платиновых металлов. Поэтому переработке шламов уделяют большое внимание. Из шла-мов электролиза сульфидных анодов получают, кроме того, селен и элементарную серу.
Электролиз металлических анодов. Шлам электролиза металлических анодов содержит обычно 30—35% Ni, 20—25% Сu, 1 — 2% Fe, 0,4—0,6% Со, 30—40% S. В шлам переходят также практически все платин0иды. Содержание последних в шламах разных заводов колеблется в широких пределах — от 0,1 до 2%
Переработка шламов производится по различным технологическим схемам, учитывающим специфику данного шлама. Обычно вначале шлам обжигают с целью окисления сульфидов. Огарок подвергают выщелачиванию в серной кислоте, при этом в раствор переходят никель, железо, частично медь. Твердый остаток от выщелачивания плавят с восстановителем в электропечах и полученный металлический сплав, содержащий в основном медь и платиноиды, отливают в аноды и подвергают электролизу в растворе серной кислоты. На катоде осаждается губчатая медь, содержащая некоторое количество платиноидов, основная же их масса выпадает в шлам. Губчатую медь растворяют в серной кислоте в присутствии кислорода. Платиновые металлы остаются в остатке от выщелачивания. Этот остаток и шлам электролиза представляют собой концентрат платиновых металлов, содержание которых достигает в нем 50%. Концентрат направляют на разделение и извлечение платиноидов на аффинажный завод.
Электролиз сульфидных анодов. Шлам сульфидных анодов содержит около 97% элементарной серы, 0,7% сульфидной серы, 1,3% Ni, 0,3% Сu, 0,6% Fe, 0,15% Se (в элементарном виде). Шлам плавят в котлах при температуре около 135° С и расплав фильтруют на обогреваемых паром фильтрах. В фильтрат переходит до 95% элементарных серы и селена, в остатке остаются сульфиды и платиноиды. Фильтрат подвергают дробной дистилляции для разделения серьги селена. Последние являются товарными продуктами. Oстаток от фильтрации содержит около 50% серы, остальное — металлы. Этот остаток плавят и отливают в аноды. Эти так называемые вторичные аноды содержат около 50% Ni, 20% Сu, 2% Fe и 20—25% серы, т. е. являются также сульфидными. Их подвергают электролизу в тех же условиях, что и исходные, первичные сульфидные аноды. Шлам электролиза вторичных анодов содержит около 90% элементарной серы, в него переходит также часть сульфидов и все платиноиды. Элементарную серу вторичного шлама отделяют плавлением и фильтрацией. Полученный вторичный остаток содержит около 10% платиновых металлов и направляется на аффинаж.
Гидроэлектрометаллургия никеля
Помимо электролитического рафинирования никеля с металлическими или сульфидными анодами, в настоящее время осуществляется в небольших масштабах гидроэлектрометаллургический способ получения никеля, включающий выщелачивание никель содержащего продукта и электроэкстракцию с нерастворимыми анодами. По этой схеме работает завод Харьявалта в Финляндии.
Медно-никелевый сульфидный концентрат, полученный после обогащения руды на обогатительной фабрике, плавится в печи взвешенной плавки на штейн. Штейн продувается воздухом в конверторах. При конвертировании получают металлизированный файнштейн, содержащий 60—63% Ni, 28—30% Сu, 7—9% S и 0,4% Fe. Глубокая металлизация файнштейна (снижение содержания серы ниже стехиометрического соотношения в сульфидах) осуществляется путем переокисления сульфидной массы в конверторе. Она необходима для последующего выщелачивания файнштейна. В металлизированном файнштейне сера связана в сульфиде меди Cu2S, а никель находится в основном в металлической форме. Поэтому при выщелачивании в раствор переходит только никель, а медь остается большей частью в нерастворимом сульфиде.
Выщелачивание файнштейна ведется в две стадии, по тому же принципу, что и в гидрометаллургии цинка.
В кислой стадии выщелачивание производится отработанным электролитом ванн электроэкстракции никеля, содержащим 40 г/л свободной серной кислоты. Во второй стадии электролит нейтрализуют до рН = 6 свежим файнштейном; при этом происходит гидролитическая очистка раствора от железа и свинца. В нейтральной стадии происходит также очистка раствора от меди благодаря ее цементации металлическим никелем файнштейна.
Раствор после фильтрации поступает на гидролитическую очистку от кобальта. Очищенный от примесей раствор содержит около 70 г/л Ni, а также сульфат натрия и борную кислоту. Он поступает на электроэкстракцию никеля.
К Основной реакцией электроэкстракции, так же, как и в гидрометаллургии меди, цинка, кадмия и других металлов, является реакция
NiSО4 + Н2О → Ni + H2SО4 + 0,5О2
Поскольку катодное выделение никеля возможно только в слабокислых растворах, а на аноде при электроэкстракции выделяется свободная кислота, электролиз ведут при тщательном разделении катодного и анодного пространств диафрагмами. Таким образом, и при электроэкстракции никеля, и при его электролитическом рафинировании необходимо предотвратить попадание электролита из анодного пространства в катодное, однако, причины изоляции катода от анода в этих двух случаях совершенно различны.
Электроэкстракцию ведут в ваннах со свинцовыми анодами и никелевыми катодными основами, получаемыми в матричных ваннах на матрицах из нержавеющей стали.. Ванны имеют размеры 6600X1150X1200 мм, в каждой ванне размещается 40 анодов и 39 катодов. Катоды помещаются в катодные ячейки, изготовленные из стальных прутков, покрытых полихлорвинилом и обтянутых териленовой тканью. Уровень католита в катодной ячейке поддерживается на 100—120 мм выше уровня анолита в ванне. Величина рН католита колеблется в пределах 3—3,5. Анолит содержит 40— 46 г/л никеля, 30—40 г/л свободной серной кислоты, 100 г/л сульфата натрия и 15 г/л борной кислоты. Температура в ванне около 60° С.
Для улавливания выделяющегося на аноде кислорода аноды имеют в верхней своей части специальный козырек, находящийся ниже уровня анолита. Кислород отводится из-под козырька по трубке. Он используется для окисления железа в процессе очистки раствора от примесей.
Плотность тока при электроэкстракции составляет 175—180 а/м2. Напряжение на ванне 3,4—3,6 в. Катодный выход по току равен 91— 96%. При этом расход электроэнергии составляет 4000— 4300 квт • ч/т катодного никеля.
Статья на тему Получение никеля


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.