ЭЛЕКТРОЛИТИЧЕСКОЕ РАФИНИРОВАНИЕ НИКЕЛЯ

Анодное растворение чернового никеля в серной кислоте из-за малого тока обмена требует значительной поляризации. При малой скорости образования ионов Ni2+ по мере повышения плотности тока на аноде возникают пленки окислов.
Рис. . Схема ячейки электролитной
ванны:
1 — аноды; 2 — катод; 3 — диафрагма
а. Ni + Н2О — 2е = NiO + 2Н+, Е0 = 0,12 В,
б. 3NiО + Н2О — 2е = Ni3О4 + 2Н+, Е0 = 0,90В,
в. 2Ni3О4 + H2О — 2e=3Ni2О3+2H+, Е0= 1,30В,
г. 3Ni2О3 + Н2О — 2e = 2NiО2+2H+, Е0 = 1,49 В.
Если учесть высокое перенапряжение кислорода на пленке окислов, образование их до начала реакции представляется вполне вероятным. В сульфатном электролите никелевый анод растворяется с малым выходом по току при потенциале 1,5—
Даже небольшие добавки хлоридов предупреждают пассивирование анода. Образование окисных пленок становится менее вероятным вследствие разрушения их, например по реакции:
Ni3О4 + 2Сl— + 2Н+ = 3NiO + Н2O + Cl2.
Хлор не выделяется и не накапливается в электролите: он окисляет медь, никель, сульфиды и другие составляющие анодов и шлама, в частности
Ni + Cl = Nl2+ + 2Сl—.
Константу равновесия (163) легко вычислить из формул (162,6) и (39)
Подставив ан+=10-3 г-ион/л и произвольно малую величину аCl-=0,1 г-ион/л, получим условия возможности протекания реакции:
[Сl2] ≤ 2 • 10-15 • 10-6 • 10-2 = 2 • 10-23 моль/л. Вместе с тем для реакции
— 0,23- 1,36
pК = (— 0,23 —1,36):0,06)2 = —53
Подставив значение aNi2+ = 1 г-ион/л и аСl-=0,1 г-ион/л в
получим [Сl2] = 10-55 моль/л.
Из сопоставления равновесных концентраций хлора в реакциях (163) и (164) очевидна невозможность образования окисной пленки на никелевых анодах даже при весьма малой активности ионов хлора.
В практике электролиза никеля, начиная с 1939 г., постепенно повышается ионное отношение Сl—: SO24— в электролите с 0,15 до 1,5. Состав одного из современных растворов дан ниже:
Ион……Ni2+ Na+ SO24— Сl— Н3ВO3
Концентрация: 88 25 115 60 5 г/л . . .
г-ион/л (моль/л) 1,50 1,1 1,2 1,7 0,08
Полная замена сульфатов хлоридами не выгодна: электропроводность от этого повысится, и напряжение на ванне станет
ниже, но уменьшится и приход тепла, необходимый для поддержания температуры электролита около 60° С.
Заводские аноды содержат 80—92% никеля. Содержание примесей должно быть не более: меди 5, железа 4, кобальта 1, платиноидов — преимущественно платины и палладия суммарно 0,1%.
Несмотря на присутствие хлоридов, аноды требуют значительной поляризации, несколько понижаемой подогревом раствора. Они растворяются при потенциале около 0,35 В, который почти на 0,6 В положительнее равновесного. Дополнительной причиной тому служат неметаллические включения и поверхностные отложения в виде корки, вызывающей концентрационную поляризацию.
Основная составляющая анодов — твердый раствор меди и никеля, содержащий включения сульфидов тех же металлов и примеси.
Медь переходит в раствор по схеме 13 (см. табл. 4), а кроме того, дает комплексные ионы:
Сu + Сl—— е = СuСl (рПР = 5,92), Е° = 0,14 В,
Сu + 2Сl— — е = CuCl—2, Е0 =0,21 В.
Для сульфида меди вычислено:
Cu2S + 2Сl— — 2е = 2CuCl + S; Е0 = 1,05 В,
Cu2S + 6Сl— — 2е = 2СuСl23— + S, Е0 = 1,09 В.
Из сопоставления этих данных с потенциалом растворяющегося анода видна малая вероятность растворения Cu2S, он накапливается в поверхностной корке и шламе, где бывает до 20% меди. Сульфид никеля также здесь присутствует, хотя потенциал его окисления сравнительно невелик:
Ni3S2 — 6е = 3Ni2+ + 2S, Е0 = 0,35 В.
Надо заметить, что электрический контакт частиц сульфидов в слое шлама на поверхности анодов, вероятно, нарушает присутствующая здесь элементарная сера. Присутствие элементарной серы в шламе и в корке на аноде подтверждает это. Вместе с тем накапливаются и ионы SO24— электролите. Окисление S2-
или S0 до сульфата многостадийно из-за возможности промежуточного образования SO23— и SnO2m—.
По литературным данным, из суммарных уравнений для кислых растворов приемлемо следующее:
S2- + 4Н2O — 8е = SO24— + 8Н+, Е0 = 0,15 В.
Селениды и теллуриды меди и никеля вместе с платиновыми металлами и не полностью растворенными обломками анодов выпадают в шлам, выход которого составляет приблизительно
2—5% от массы чернового никеля.
Статья на тему Электролитическое рафинирование никеля

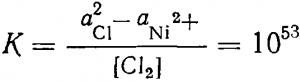
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.