Электролитическое рафинирование меди
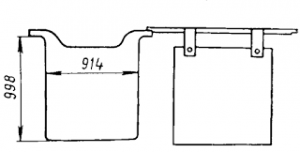
Аноды имеют особую форму, удобную для подвешивания в электролитной ванне. Катодные основы — тонкие листы из чистой меди толщиной 0,7 мм;
по длине и ширине они на 30—40 мм больше анодов. Катоды подвешивают на ломиках, продетых в прикрепленные для этого ушки (рис.1). Те и другие электроды размещают в электролитной ванне, заполненной раствором CuSO4 и серной кислотой. Все аноды, подвешенные поочередно с катодами, соединены с положительным, а катоды — с отрицательным полюсом источника постоянного электрического тока. Расстояние между одноименными электродами 10—12 см.
Рис. 1. Анод (а) и катод (б) для рафинирования меди
Анодная медь растворяется по схеме, а на катодах Сu2+ из электролита восстанавливаются, смещая равновесие той же окислительно-восстановительной системы влево (34). Если не принимать во внимание поведение сравнительно малых количеств примесей, растворение и осаждение меди следует признать основными электродными процессами, требующими наименьшей энергии активации. При умеренных плотностях тока на аноде невозможно попутное окисление воды (38) или тем более иона сульфата (см. систему 20 в табл. 4).
Аноды и катоды находятся в одном растворе и потенциалы их весьма близки; однако катодный несколько отрицательнее, а анодный несколько положительнее равновесного, в меру применяемой плотности тока и возникающей от этого концентрационной поляризации.
В тонких приэлектродных слоях электролита, где действуют силы притяжения, прочно удерживающие диполи воды, ионы перемещаются только весьма медленной молекулярной диффузией, а перемешивание здесь почти не сказывается. Скорость диффузии выражается уравнением закона Фика
где υ=dm/dt— скорость движения ионов к электроду или от него в раствор, г-ион•с-1; 5—площадь электрода, см2; С1, С2 и С3—концентрации переносимого вещества на границах диффузионного слоя и у поверхности электродов г-ион/см3; х, хг— толщина этого слоя, см; Кд— коэффициент диффузии, свойственный данному иону, см2•с-1.
По ходу электролиза концентрация меди (С1) снижается, и скорость диффузии убывает, а количество электронов, поступающих на единицу поверхности катода из внешней цепи, остается постоянным. Оно зависит от плотности тока — силы его в соответственно в прикатодном и прианодном слоях раствора амперах, приходящейся на единицу площади электрода. Из этого очевидно накопление избытка электронов на катоде с увеличением плотности тока — его поляризация — отрицательное смещение потенциала от равновесной величины. Аналогичные явления наблюдаются на аноде из-за медленного отвода в раствор ионов меди — возникает недостатокэлектронов. Поляризация здесь отличается положительным сдвигом равновесного потенциала. Все это иллюстрируется схемой.
Рис. 3. Схема концентрационной поляризации при электролитическом рафинировании меди С1 — средняя концентрация меди в электролите; С2 и С3 — концентрации меди.
Напряжение на ванне при электролизе с растворимым дом соответствует уравнению; однако величина Е а—Ек здесь зависит только от поляризации, а равновесные составляющие электродных потенциалов одинаковы.
Примеси, потенциалы окисления которых отрицательнее, у меди, растворяются в электролите, а более положительные элементы и соединения выпадают в осадок на дно ванны — шлам.
По приближенной оценке (см. табл. 4) к первым, помимо пинка, железа, никеля и кобальта, относятся мышьяк, сурьма и висмут. Гидролизуясь при переходе в раствор, они имеют окислительно-восстановительные системы, включающие воду и Н+:
2Sb + 3Н2O — 6е = Sb2O3 + 6Н+; Е0 = 0,15 В,
As + 2Н2O — 3е = HAsO2 + 3Н+; Е0 = 0,25 В,
Bi + Н2O — 3е = ВiO+ + 2Н+; Е0 = 0,32 В.
Примеси более положительные, чем медь, золото, серебро, Cu2Te, Cu2S, Cu2Se и подобные соединения серебра выпадают в шлам. Сюда же переходит свинец, катион которого в сернокислом растворе дает осадок PbSO4, а также твердые гетерополи-кислоты мышьяка и сурьмы. Cu2O растворяется без затрат тока, но выделяет осадок меди:
Cu2O + H2SO4 = CuSO4 + Cu + H2O.
Пример состава шлама приведен ниже:
Примесь . . . . Ag Au Сu Se Те S Pb As Sb Bi
Содержание, %… 35 2 5 14 6 8 15 3 6 0,3
(по массе)
Нерастворимые осадки, содержащие сурьму и мышьяк, выпадают по мере накопления этих элементов в растворе и окисление кислородом воздуха.
Поверхностное загрязнение отдельных участков анодов увеличивает поляризацию соседних, в результате чего становится возможным образование Сu+:
Cu + e = Cu+; Е0 = 0,52В.
Однозарядные ионы нестойки, они тотчас диспропорционируются, выделяя мелкую медь:
2Cu+ = Сu2+ + Сu.
Реакция состоит из двух окислительно-восстановительных систем :
Cu+ — е = Сu2+; Е0 = 0,15В. (111)
В первой Сu+ — окислитель, а во второй — восстановитель.
При высокой поляризации возможно также и некоторое выделение на аноде кислорода.
Легкие частицы нерастворимых веществ взмучиваются от движения электролита либо флотируются пузырьками газов, образуя плавучий или блуждающий шлам (до 50% Sb, 18% As и 0,5% Bi).
На катоде атомы, возникающие при разряде Сu2+, формируют кристаллы меди, прочно пристающие к основе. Из данных о потенциалах примесей следует, что последние не могут осаждаться вместе с медью: цинк, железо, висмут, мышьяк, никель, сурьма и олово более электроотрицательны, они остаются и накапливаются в ванне.
Катодный осадок загрязняется главным образом в результате захвата раствора и плавучего шлама. Для предупреждения этого часть электролита периодически удаляют и очищают (регенерируют), а затем снова возвращают в ванны. Иногда выведенный электролит перерабатывают отдельно, а в ванны заливают разбавленную серную кислоту.
Затраты на электроэнергию составляют значительную долю себестоимости рафинирования, они выражаются уравнением.
Количество тока, необходимое для получения 1 т катодной меди, легко вычислить по закону Фарадея. Если на выделение из раствора одного эквивалента ее, равного 63,54 : 2 =31,77 г, требуется 26,8 А•ч, то на 1 т будет израсходовано
It = (1 • 106 • 26,8) : (31 • 77) = 0,84 • 106 A•ч.
Расход энергии
W=0,84•103• (υ• КТ) кВт•ч/т.
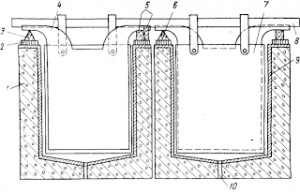
Рис. 4. Железобетонная ванна для электролитического рафинирования меди: 1 — ванна; 2 — изоляция; 3— медная шина; 4 — анод; 5 — изоляторы; 6 — промежуточная шина; 7—катод; 8 — катодная штанга; 9 —ограничитель из винипласта; 10 — отверстие для выгрузки шлама.
Из этого следует, что основные условия экономического про-ведения электролиза — высокий выход по току и малое падение напряжения на ванне, главная составляющая которого — преодоление сопротивления электролита.
Удельное сопротивление растворов сернокислой меди несколько возрастает с повышением концентрации, но резко снижается при подкислении серной кислотой и нагревании. Соответственно этому электролиз ведут в подкисленном растворе, нагретом до 60-65° С; обычно содержащем 40—50 г/л меди и 150—200 г/л серной кислоты.
Расстояния между анодом и катодом должно быть минимальным, однако исключающим их замыкание. Кроме того, необходима свободная циркуляция раствора для выравнивания его состава.
Высокая плотность тока повышает производительность ванн; однако одновременно сильнее падает напряжение в электролите и возрастает поляризация, а следовательно, и расход энергии.
Ванны для электролиза (рис. 4) отливают из железобетона или собирают из стандартных железобетонных плит, соединенных болтами. Дно набирают из досок. Внутри их защищают от действия электролита листами винипласта, сваренными в стыках
Размеры ванны зависят от величины и числа электродов, длина ее бывает 3,0—6,0 м, ширина внутри на 120—130 мм больше ширины катодов, глубина 1 —1.3 м. Общее число электродов до 109, анодов на один меньше, чем катодов.
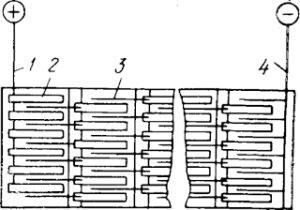
Рис. 5 ванн: Схема электрической цепи 1 — анодная шина; 2 — анод; 3 — катод; 4 — катодная шина горячим воздухом, иногда вместо пластмассы применяют листовой свинец, находя его более долговечным и надежным.
Для экономии материалов, удобства размещения в цехе и обслуживания ванны соединяют в блоки по 40—50 шт, а иногда и в более крупные. Блоки ставят на железобетонных колоннах высотой до 6 м, это позволяет осматривать и
ремонтировать их снизу. Для предупреждения утечек тока прокладывают фарфоровые или диабазовые изоляторы. Электроды включают в цепь последовательно, накладывая ломики катодов на концы анода соседней ванны (рис. 5).
Электролит непрерывно поступает в каждую ванну из общей магистрали, идущей от напорных баков. В баках или по пути из них его подогревают паром. Место ввода электролита находится у одного торца ванны внизу, а сливной патрубок — у противоположного вверху. Интенсивность циркуляции выбирают опытным путем; обычно она соответствует обновлению раствора в течение 3—4 ч. Для уменьшения потерь тепла поверхность электролита иногда покрывают поплавками из пластмассы, пластмассовыми пленками или органическими пенами.
Обслуживание установки состоит в устранении коротких замыканий и наблюдении за чистотой контактов, температурой электролита, циркуляцией его и напряжением на ванне. На современных заводах введен автоматический контроль состава электролита и режима электролиза, а управление циркуляцией автоматизировано.
Для питания постоянным током применяют мотор-генераторы, в последнее время — также кремниевые выпрямители,дающие ток силой до 13000 А при напряжении 150—300 В.
Выход по току при рафинировании 94—97%, расход энергии на 1 т меди 200—400 кВт•ч.
Аноды растворяются в течение 22—24 сут, остатки их около 15% (до массе) возвращаются на отливку.
Медь выделяется на катодах в виде прочного плотного осадка; однако равномерность роста его с течением времени нарушается, на поверхности появляются неровности, выступы, шишкообразные наросты. Выступающие части растут быстрее: в местах их возникновения сопротивление между анодом и катодом уменьшается. Неровный и неплотный осадок захватывает много электролита и плавучего шлама; неравномерность отложения меди иногда вызывает короткие замыкания электродов. Небольшие добавки в раствор ПАВ — столярного клея, желатины, таннина, отходов целлюлозного производства — способствуют получению ровных, плотных и чистых катодов. Расход ПАВ составляет от десятых долей грамма до десятков граммов на тонну меди. На некоторых наших заводах успешно пользуются тиомочевиной и желатиной.
Катоды наращивают 6—8 сут, затем извлекают, промывают, сушат, переплавляют в пламенных, индукционных или шахтных печах и разливают медь в слитки особой формы, предназначенные для изготовления проволоки — вайербарсы или иные.
Для установки и выгрузки электродов из ванн пользуются бороной— рамой с крючьями, переносимой мостовым краном.
Обычная чистота катодов 99,95% (марка МО). На некоторых заводах, периодически фильтрующих электролит и работающих при пониженной плотности тока, получают металл марки М00, содержащий 99,965—99,957% меди.
Загрязнение кислородом происходит при плавке и розливе, он понижает пластичность и электропроводность меди, поэтому некоторые потребители предпочитают получать катоды, минуя плавку. Также нежелательна примесь серы, переходящая в металл из газов пламенных печей, после плавки в них медь содержит до 0,04% кислорода и 0,012% серы, после индукционных печей серы и кислорода часто меньше 0,01%. На некоторых заводах применяют теперь шахтные печи, обогреваемые бессернистым коксом, или иные, имеющие восстановительную среду. В металле остается 3 • 10-4% кислорода и 1,5•10-3% серы.
Статья на тему Электролитическое рафинирование меди

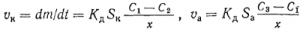

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.