Химические элементы третьего периода периодической таблицы включают:
Эти элементы имеют общую электронную конфигурацию с заполняемым третьим энергетическим уровнем, что определяет их химические свойства и реакции.
Натрий, магний являются металлами, образы которых внешние электроны относятся к группе s.
Натрий активно реагирует с водой, образуя щелочной раствор, в то время как магний, менее реакционно способный, реагирует с водой только при повышенных температурах.
Алюминий, находясь в p-подгруппе, демонстрирует амфотерные свойства, реагируя как с кислотами, так и с основаниями.
Кремний, фосфор и сера являются полуметаллами и неметаллами, обладающими ярко выраженными неметаллическими свойствами.
Хлор, самый активный неметалл третьего периода, образует различные разновидности соединений с металлами и неметаллическими элементами.
Аргон, инертный газ, не участвует в химических реакциях, что делает его важным компонентом в газах для сварки и в консервации продуктов.
Физические свойства элементов третьего периода
Все элементы третьего периода доступны в промышленном масштабе или легко могут быть получены в лаборатории.
Это разнообразные по внешнему виду вещества. Мы видим такие металлы, как натрий Na, магний Mg и алюминий Al.
Свежий срез образцов этих элементов имеет типичный металлический блеск. Металлы эти мягки, особенно натрий — его обычно режут ножом.
Магний и алюминий можно сгибать руками, твердые предметы оставляют на них след.
Кремний тоже имеет металлический блеск, но он гораздо тверже магния и алюминия.
Одна из модификаций фосфора, называемая белым фосфором, — бледно-желтое, похожее на воск твердое вещество с ярко выраженными неметаллическими свойствами.
Черный фосфор, в который превращаются все другие формы фосфора под большим давлением, представляет собой темно-серое твердое вещество с металлическим блеском.
Завершают период два газа — хлор и аргон, которые по внешнему виду, совсем не похожи на металлы.
Натрий, магний и алюминий. Твердые вещества — металлы
Низкая энергия ионизации и свободные валентные орбиты у одного из этих элементов являются причиной существования газового облака подвижных валентных электронов.
Подвижные электроны удерживают атомы в кристалле металла и одновременно обусловливают высокую проводимость тепла и электрического тока.
Можно отметить также, что металлическая связь становится более прочной с увеличением числа валентных электронов в атоме и энергии ионизации.
Общая тенденция в изменении физических свойств металлов третьего периода объясняется увеличением числа и энергии ионизации валентных электронов.
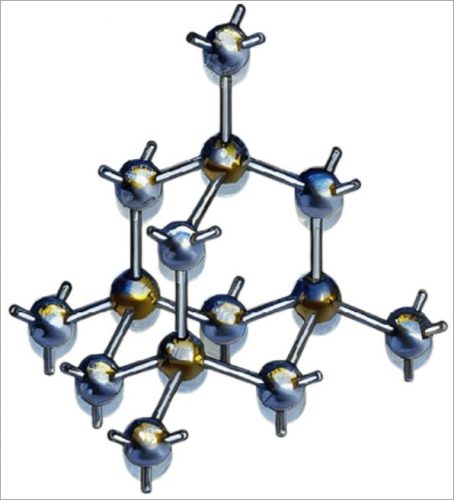
Кремний сетчатое твердое вещество
Рис. Кристаллическая структура кремния
Кремний по внешнему виду похож на металл, к металлам обычно не относят. Электропроводность кремния настолько электропроводности обычных металлов, что его называют пол ником.
Кремний является образцом сетчатых твердых веществ (рис.), атомы в его кристалле расположены так же, как и в алмазе.
Каждый атом кремния окружен четырьмя другими атомами кремния и связан с ними ковалентными связями.
Следовательно, кристалл кремния можно рассматривать как одну гигантскую молекулу.
Почти все валентные электроны в кристалле кремния локализованы в ковалентных связях и не могут свободно проводить тепло или электрический ток через кристалл.
С другой стороны, в твердом веществе всегда имеется небольшое число валентных электронов, которые обладают достаточной энергией и поэтому не локализованы.
Эти электроны и обусловливают небольшую, но заметную электропроводность кремния.
Поведение кремния мы вновь можем объяснить на основе строения его атома и величины энергии ионизации.
В атоме кремния — четыре валентных электрона 3s23p2, поэтому он стремится образовать четыре ковалентные связи.
Увеличение локализации валентных электронов в ковалентных связях и почти полное исчезновение электропроводности объясняются увеличением энергии ионизации.
И отсутствием свободных валентных орбит у элементов, находящихся в конце периода.
Фосфор, сера и хлор. Молекулярные кристаллы
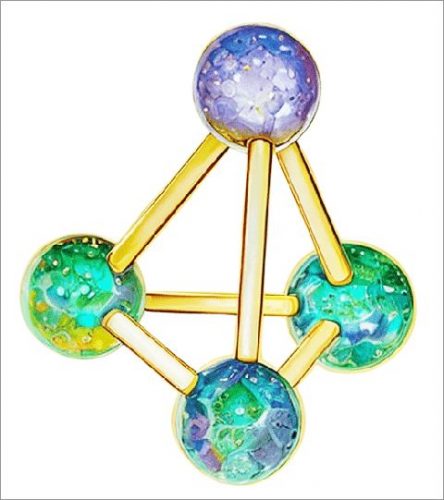
Рис. Белый фосфор Р4, структура молекулы
Энергия ионизации атома фосфора еще выше, чем у кремния. Поэтому обычные формы фосфора представляют собой молекулярные кристаллы.
Белый фосфор состоит из отдельных молекул Р4 (рис. 2), соединенных в твердом кристалле слабыми вандер-ваальсовыми силами.
На основании электронной конфигурации атома фосфора можно объяснить состав и строение молекулы Р4.
Фосфор имеет электронную конфигурацию 1s2s2p63s23p3, и, так как 3р-орбиты заполнены лишь наполовину, можно предположить, что фосфор будет образовывать три ковалентные связи.
Геометрически такая связь должна быть похожа на связь в аммиаке NH3, в котором три связи N—Н образуют пирамиду с треугольным основанием.
Как показано на рис. 2, в молекуле Р4 каждый атом фосфора действительно образует три связи, и каждый атом находится в одной из вершин пирамиды.
Рис. Структура молекулы серы S8.
Электронная конфигурация атома серы (3s23p4) предполагает, что каждый атом должен образовывать две ковалентные связи, используя две заполненные наполовину 3р-орбиты.
Такое строение действительно обнаружено в молекулах S8, из которых состоят обычные модификации твердой серы.
Молекулы S8, по-видимому, имеют форму изогнутого кольца, как показано на рис. 3.
Так же как и в случае фосфора, устойчивость кристалла, построенного из молекул серы такой клинической формы, обусловлена действием вандерваальсовых сил между отдельными молекулами.
Электронное строение атома хлора (3s23р5) удовлетворительно объясняет также существование основной формы этого вещества.
Единственная заполненная наполовину 3р-орбита может быть использована для образования одной ковалентной связи, поэтому хлор существует в виде двух атомных молекул.
У атома аргона все валентные орбиты с низкой энергией заняты электронами, и возможность образования химических связей между атомами отсутствует.