Азотистая кислота слабая одноосновная высокотоксичная неорганическая кислота. При стандартных условиях неустойчива и частично разлагается на азотную кислоту, оксид азота и воду.
В водных условиях возможно частичное разложение, поэтому в закрытых емкостях всегда присутствует оксид азота (VI) NO2.
Химическая формула — HNO2, применяется в получении некоторых органических и неорганических веществ например азидистой кислоты.
Что такое азотистая кислота
Если нагревать калиевую или натриевую селитру, то они теряют часть своего кислорода и переходят в соли азотистой кислоты HNO2.
Разложение идет легче в присутствии свинца, связывающего выделяющийся кислород:
KNO3 + Pb = KNO2 + PbO
Соли азотистой кислоты — нитриты — кристаллические вещества, хорошо растворимые в воде (за исключением серебряной соли).
Нитрит натрия NaNO2 широко применяется при производстве различных красителей.
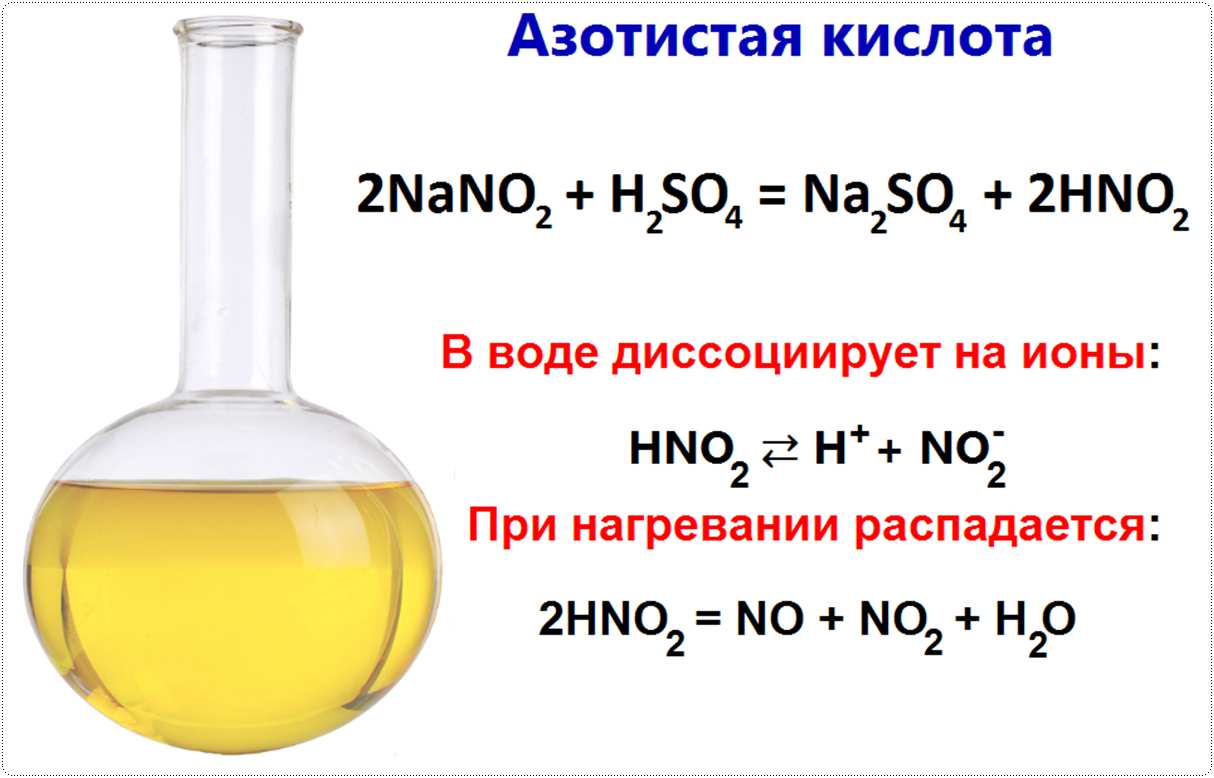
Может быть получена при действии на раствор какого-нибудь нитрита разбавленной серной кислотой получается свободная азотистая кислота:
2NaNO2 + H2SO4 = Na2SO4 + 2HNO2
Физические свойства
Так как это неустойчивая кислота, поэтому существует только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. В больших концентрациях токсична.
Состоянии: в водном растворе — жидкость; в чистом виде — газ. Молярная масса 47,0134 г/моль. Плотность 1,685 (жидкость). Температура плавления 42,35 °C, кипения 158 °C.
Рис. Структурная формула азотистой кислоты.
Химические свойства
В водных растворах азотистая кислота диссоциирует на ионы:
HNO2 ⇄ H+ + NO2—.
Она принадлежит к числу слабых кислот (К = 5 • 10-4) и известна только в сильно разбавленных водных растворах.
2HNO2 ⇄ H2O + N2O3 ⇄ H2O + NO + NO2.
Азотистая кислота — сильный окислитель, но в то же время при действии других, более энергичных окислителей сама может окисляться в азотную кислоту:
3HNO2 = HNO3 + H2O + 2NO↑.
При концентрировании раствора или при его нагревании азотистая кислота распадается с выделением окиси и двуокиси азота:
2HNO2 = NO + NO2 + H2O
При действии окислителей азотистая кислота окисляется до азотной кислоты:
HNO2 + Cl2 + H2O = HNO3 + 2HCl;
HNO2 + H2O2 = HNO3 + H2O.
С ароматическими аминами при действии азотистой кислоты образуются соли диазония:
C6H5NH2 + HNO2 + HCl = [C6H5-N=N]Cl + H2O.
Окислительные свойства азотистой кислоты
Может проявлять окислительные свойства. В зависимости от природы восстановителя она может восстанавливаться до NO, N2O, NH2OH, NH3.
Примером может служить йодо водород, атомарный водород:
2HNO2 + 2HI = 2NO + I2 + 2H2O,
HNO2 + 4[H] = NH2OH + H2O.
При реакции с гидразином получается азотистоводородная кислота:
HNO2 + N2H4 = HN3 + 2H2O.
Получение
В лабораторных (домашних) условиях может быть получен из его солей действием разбавленной серной кислотой:
2KNO2 + H2SO4 → Ka2SO4 + 2HNO2
Растворением в воде оксида азота N2O3:
N2O3 + H2O → 2HNO2
Растворение оксида азота NO2 в воде:
2NO2 + H2O → HNO3 + HNO2
Но в этой реакции она не устойчивая и медленно переходит в азотную кислоту.
Применение
В получении солей азотистой кислоты, примером могут служить нитрит натрия и калия и другие.
Нитрит натрия применяется в производстве некоторых органических веществ, а именно в получении фталевого ангидрита который используется в производстве некоторых красок и лаков.
Диазотирование первичных ароматических аминов и образование солей диазония.
Быстрые ответы?
Концентрированная азотная кислота HNO3 это жидкость, а концентрированная азотистая кислота HNО2 это газ.
Применяется для диазотирования первичных ароматических аминов и образования солей диазония. Нитриты применяются в органическом синтезе в производстве органических красителей.
Весьма токсична, причём обладает ярко выраженным мутагенным действием, поскольку является дезаминирующим агентом.

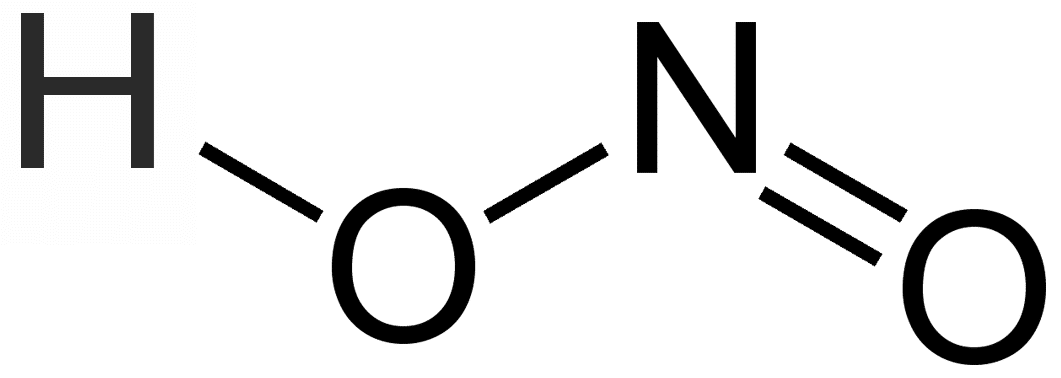
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.