Теория:
Валентность и степень окисления лития (Li) — это способность элемента образовывать химические связи и приобретать соответствующий условный заряд в соединениях.
Поэтому во всех стабильных соединениях литий проявляет постоянную валентность I (один).
Его степень окисления в подавляющем большинстве случаев всегда равна +1, поскольку литий является крайне электроположительным элементом и всегда отдает свой единственный внешний электрон.
Будучи металлом I группы, литий не способен принимать электроны и не имеет устойчивых соединений, в которых проявлял бы отрицательную степень окисления.
Литий является элементом, для которого в стабильном состоянии характерны только одни значения валентности (I) и степени окисления (+1).
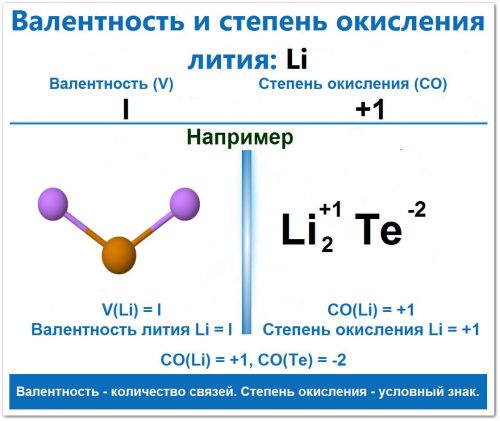
Зависимость степени окисления от валентности лития
Для лития (Li) понятия валентности и степени окисления тесно связаны и практически неразделимы, поскольку элемент всегда стремится отдать свой единственный электрон.
Его электронная конфигурация: 1s2 2s1.
На внешнем уровне находится 1 электрон.
Валентность (V) I
Атом лития образует одну ковалентную или ионную связь, используя свой единственный неспаренный электрон 2s1.
Степень окисления (СО) +1
Литий всегда отдает свой внешний электрон, приобретая устойчивую конфигурацию инертного газа Гелия (He).
Следовательно, его условный заряд всегда равен +1.
Валентность (V) лития
Валентность лития (то есть, число химических связей, которые он может образовать) во всех его соединениях постоянна и равна I (одному).
Это обусловлено тем, что атом лития имеет всего один внешний электрон (2s1).
Чтобы достичь стабильной, полностью завершённой оболочки (как у Гелия), ему нужно этот единственный электрон отдать.
Он всегда стремится образовать именно одну связь (либо ионную, либо ковалентную).
➡️ Валентность I (Один)
Используется один внешний электрон (2s1) для формирования одной связи (одной общей электронной пары или ионного притяжения).
Одна одинарная связь: Пример: в оксиде лития (Li2O). Каждый атом лития связан с одним атомом кислорода одинарной связью.
Li — O — Li
Одна ионная связь: Пример: в хлориде лития (LiCl). Атом лития отдает электрон хлору, образуя одну ионную связь.
➡️ Исключения (отсутствуют)
В отличие от многих других элементов, валентность лития не меняется.
Для Лития не характерно образование двойных связей или использование нескольких внешних орбиталей, так как он имеет только один электрон для связи и не имеет свободных орбиталей с близкой энергией, чтобы его возбудить.
Валентность лития (то есть, число химических связей, которые он может образовать) во всех его соединениях постоянна и равна I (одному).
Это обусловлено тем, что атом лития имеет один внешний электрон и для достижения стабильной завершенной оболочки ему необходимо этот электрон отдать. Он всегда стремится образовать именно одну связь.
Степень окисления (СО) лития
Степень окисления лития (условный заряд) тесно связана с его валентностью (I), но, из-за своей крайне низкой электроотрицательности (высокой электроположительности), в подавляющем большинстве соединений она всегда положительна.
Литий является щелочным металлом, который стремится отдавать электроны.
➡️ СО = +1: Единственное устойчивое и распространенное состояние
Это основное состояние лития, в котором он отдает свой единственный внешний электрон 2s1, достигая стабильной конфигурации инертного газа Гелия (He).
Пример: в оксиде лития (Li2O). СО(Li) = +1, СО(O) = -2.
Пример: в хлориде лития (LiCl). СО(Li) = +1, СО(Cl) = -1.
Пример: в простом веществе (металл Li). СО(Li) = 0. (Это нейтральное состояние, но не степень окисления в соединении).
➡️ СО = -1: Нехарактерное состояние
Это состояние практически не встречается в стабильных химических соединениях.
Литий не является достаточно электроотрицательным, чтобы принять электрон.
Исключение: В лабораторных условиях могут быть получены крайне неустойчивые интерметаллические соединения (например, с более электроположительными щелочноземельными металлами).
Где литий формально может быть более электроотрицательным.
Однако в химии это состояние не используется и не рассматривается.
➡️ Другие положительные состояния (СО = +2, +3 и т.д.)
Литий имеет всего один внешний электрон 2s1.
Для достижения степеней окисления выше +1 ему пришлось бы отрывать электроны от внутренней, завершенной оболочки (1s2), что требует колоссальной энергии.
Следовательно, ни одно другое положительное состояние лития (СО = +2 или выше) невозможно в химических соединениях.
СО = +1 является единственным устойчивым ионным состоянием для лития.
Валентность и степень окисления на примере оксид лития Li2O
В соединении оксид лития Li2O участвуют два элемента: литий Li — щелочной металл, и кислород O — неметалл.
➡️ Валентность (V)
Валентность показывает число химических связей, которые образует атом элемента в соединении.
Валентность Лития (Li): всегда имеет постоянную валентность I (один), так как у него есть только один внешний электрон для образования связи.
Валентность кислорода (O): Кислород (O) в оксидах имеет постоянную валентность II (два).
Это значит, что он образует две химические связи.
Li2O можно представить как Li — O — Li.
➡️ Степень окисления (СО)
Степень окисления показывает условный заряд атома, предполагая, что все связи являются ионными.
Степень окисления лития (Li): Литий (металл) является очень электроположительным и всегда отдает свой единственный внешний электрон.
Поэтому СО(Li) = +1.
Степень окисления кислорода (O): Кислород (сильный неметалл) принимает электроны от менее электроотрицательного лития.
Он принимает два электрона для достижения стабильности, поэтому СО(O) = -2.
➡️ Соотношение валентности и СО
Численное значение валентности (Li = I, O = II) совпадает с численным значением СО (Li = 1, O = 2).
СО имеет знак: СО (Li) = +1, СО(O) = -2. Валентность знака не имеет: V(Li) = I, V(O) = II.
Пример решения, задача:
▶️ Дано:
Соединение хлорид лития (LiCl)
⌕ Найти:
Определите валентность (V) и степень окисления (СО) в соединении.
✨ Решение:
Валентность (V): Литий (I группа) и Хлор (в хлоридах) всегда образуют по одной связи. Li и Cl имеют V = I.
Степень окисления (СО): Литий (металл) отдает электрон, хлор (галоген) принимает электрон.
СО (Li) = +1
СО (Cl) = -1
✅ Ответ:
Его валентность равна I, степень окисления +1.
Часто задаваемые вопросы:
Являются фиксированными и постоянными в его соединениях.
Валентность (V): I (одна).
Степень окисления (СО): +1.
Самым стабильным состоянием лития является его ионное состояние в соединениях — ион Li+.
Отличается от его степени окисления (СО) только наличием знака.
В химических соединениях оба понятия имеют одинаковое численное значение, равное единице (1), что обусловлено наличием у него всего одного внешнего электрона.