Теория:
Валентность (B) — это способность образовывать в соединениях три химические связи, то есть III (три).
Это происходит потому, что бор находится в 13-й группе Периодической таблицы, что означает, что у него 3 валентных электрона.
Для достижения стабильности он чаще всего стремится образовать 3 химические связи.
Он стремится образовать три связи, чтобы достичь более стабильной электронной конфигурации (1s22s22p1).
Доказано что в очень редких и специфических условиях могут существовать соединения, где бор формально проявляет другие степени окисления.
В подавляющем большинстве стабильных и распространенных соединений бор проявляет валентность III.

Почему валентность бора равна три
Это происходит потому что:
Количество валентных электронов: У атома бора (B) на внешнем энергетическом уровне находится 3 валентных электрона (1s22s22p1).
Стремление к стабильности: В химических реакциях бор стремится достичь стабильной электронной конфигурации.
Для этого ему гораздо легче образовывать 3 химические связи (путем обобществления этих трех электронов), чем пытаться получить пять дополнительных электронов для заполнения внешнего уровня.
Поэтому эти три валентных электрона и определяют его характерную валентность III.
Валентность бора в соединениях
Валентность бора (B) в соединениях постоянна и равна III (три).
Это означает, что атом бора всегда стремится образовать три химические связи с другими атомами.
Это происходит потому, что у бора 3 валентных электрона на внешнем энергетическом уровне.
И ему энергетически выгодно образовывать связи, делясь этими электронами, чтобы достичь стабильности.
Тип связи в молекуле бора
В простом веществе бор (B) преобладает ковалентная связь.
Однако это не обычная двухцентровая двухэлектронная ковалентная связь (когда два атома делят два электрона).
Из-за того, что у бора всего 3 валентных электрона, а он стремится образовывать много связей (как правило, до 6, но с дефицитом электронов).
В кристаллической решетке бора и в его соединениях (особенно в бороводородах) наблюдается особый тип ковалентной связи — многоцентровая связь с дефицитом электронов.
Часто это называют трёхцентровой двухэлектронной связью (когда три атома делят два электрона) или более сложными многоцентровыми связями.
Это придает бору и его соединениям уникальные и сложные структуры, например, икосаэдрические кластеры в кристаллическом боре.
Визуализация строения атома Бора (B)
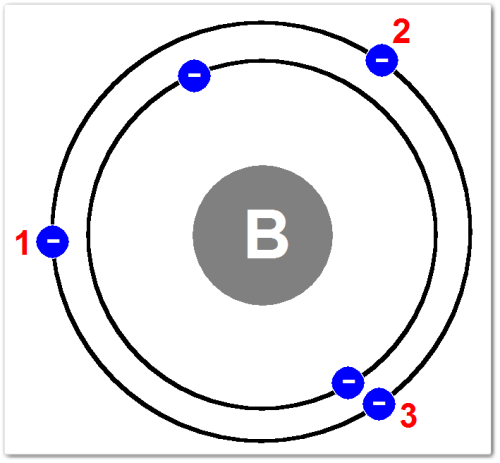
Представьте атом бора как миниатюрную «солнечную систему»:
Ядро (в центре):
Представьте его как очень маленькую, плотную, положительно заряженную точку в самом центре.
Внутри ядра Бора находится 5 протонов (положительно заряженных частиц), что и определяет его атомный номер 5 (+5).
Также там находятся нейтроны (для самого распространенного изотопа Бора-11 их 6)
Электронные оболочки (орбиты вокруг ядра):
Вокруг ядра, на разных расстояниях, располагаются электронные оболочки (или энергетические уровни), по которым движутся электроны.
✅Первая электронная оболочка (ближайшая к ядру):
Представьте её как самый маленький круг вокруг ядра.
На этой оболочке находятся 2 электрона. Эта оболочка полностью заполнена и очень стабильна.
✅Вторая (внешняя) электронная оболочка:
Представьте её как больший круг, охватывающий первую оболочку.
На этой оболочке находятся 3 электрона. Эти электроны называются валентными электронами, и именно они участвуют в образовании химических связей.
Примеры соединений бора с валентностью III
Оксид бора (B2O3):
В этом соединении два атома бора (каждый с валентностью III) связаны с тремя атомами кислорода (каждый с валентностью II).
Формула отражает, что 2 × III = 6 (суммарная валентность от бора) и 3 × II = 6 (суммарная валентность от кислорода).
Фторид бора (BF3):
Атом бора (валентность III) связан с тремя атомами фтора (валентность I).
Молекула BF3 имеет плоскую треугольную форму.
Хлорид бора (BCl3):
Аналогично фториду, атом бора (валентность III) связан с тремя атомами хлора (валентность I).
Борная кислота (H3BO3):
В этом соединении бор находится в центре, связанный с тремя гидроксильными (-OH) группами.
Валентность бора здесь также III. Можно записать как B(OH)3.
Нитрид бора (BN):
В этом соединении бор (валентность III) связан с азотом (который здесь также проявляет валентность III, так как образует три связи с бором.
Например, в гексагональной структуре, похожей на графит, или в кубической, похожей на алмаз).
Бор практически всегда проявляет валентность III в своих стабильных соединениях, что является его отличительной чертой.
Часто задаваемые вопросы:
У бора (B) одна постоянная валентность — III (три).
Хотя у него может быть несколько степеней окисления, в контексте классической валентности, он всегда стремится образовывать три химические связи.
У атома бора (B) 3 (три) валентных электрона.
Они находятся на его внешнем энергетическом уровне (электронная конфигурация 1s22s22p1).
1. По положению элемента в Периодической таблице Менделеева:
Бор (B) находится в III группе → у него 3 валентных электрона.
2. По электронной конфигурации атома.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.