Углерод — это уникальный элемент, который может быть как окислителем, так и восстановителем.
Его роль в химической реакции зависит от того, с каким элементом он взаимодействует.
Углерод проявляет свойства восстановителя, когда реагирует с более электроотрицательными элементами, такими как кислород или сера.
Он отдает электроны, и его степень окисления повышается.
Углерод выступает как окислитель в реакциях с менее электроотрицательными элементами, например, с металлами и водородом.
Он принимает электроны, и его степень окисления понижается.
Почему углерод окислитель восстановитель
Атомы всех элементов подгруппы углерода во внешнем слое содержат по четыре электрона.
Следовательно, атомы углерода могут отдавать четыре электрона, т. е. окисляться, могут и присоединять четыре электрона, т. е. восстанавливаться.
Ставится вопрос: когда же углерод является восстановителем и когда окислителем?
Почему так происходит (амфотерность)
Углерод проявляет амфотерность, то есть может быть и окислителем, и восстановителем, благодаря своей электронной конфигурации.
Атом углерода имеет четыре валентных электрона (1s22s22p2). Он находится в середине ряда электроотрицательности, что позволяет ему:
Отдавать эти четыре электрона и повышать степень окисления до +4 (выступая как восстановитель).
Принимать четыре электрона и понижать степень окисления до -4 (выступая как окислитель).
Его роль в конкретной реакции определяется электроотрицательностью другого элемента.
Пример окисления (углерод — восстановитель)
Углерод выступает как восстановитель в реакциях с более электроотрицательными элементами, например, с кислородом.
Реакция с кислородом: При горении углерод отдаёт электроны кислороду, повышая свою степень окисления от 0 до +4.
C0 + O20 → C+4O2−2 Здесь углерод — восстановитель.
Пример восстановления (углерод — окислитель)
Углерод выступает как окислитель в реакциях с менее электроотрицательными элементами, такими как металлы и водород.
Реакция с водородом: В реакции образования метана углерод принимает электроны от водорода, понижая свою степень окисления от 0 до -4.
C0 + 2H20 → C−4H4+1 Здесь углерод — окислитель.
Углерод как восстановитель
Когда углерод при взаимодействии с активными неметаллами атомы отдают электроны, т. е. играют роль восстановителей, например:
При повторении окиси углерода отмечаются её восстановительные свойства:
1) При выплавке металлов из руд:
а) Fe2O3 + 3СО = 2Fe + 3CО2 (суммарное уравнение);
б) Сu2O + СО =2Сu + СO2;
2) При взаимодействии с галогенами:
Углерод как окислитель
При соединении же с металлами и водородом углерод проявляет отрицательную валентность, т. е. является окислителем :
Окислитель и восстановитель
Отмечаются далее углерод окислитель восстановитель по реакции, имеющие место при получении газообразного топлива, а именно генераторного газа:
а также и водяного газа:
С + Н2O = СО + Н2.
Следует отметить энергетическую сторону процессов получения этих газов, а именно: экзотермический характер процессов при получении генераторного газа и эндотермический — при получении водяного газа.
В связи с этим можно дать понятие о смешанном газе, т. е. об одновременном получении генераторного и водяного газа.
Выделяющееся тепло при первом процессе используется при получении второго газа.
Из примерного основного состава этих двух газов легко выводится основной состав и смешанного газа:
(СО + 2N2) + (СО + Н2) = 2СO + Н2 + 2N2.
Из сопоставления основного состава этих газов учащиеся обычно легко делают вывод: при сгорании какого из этих газов выделяется больше тепла, какой из них обладает наибольшей калорийностью.
Таким газом будет, ясно, водяной газ, потому что обе его составные части горят:
CO + H2 + O2 = CO2 + H2O
На втором месте по калорийности стоит смешанный газ, так как процент негорючей составной части его, азота, в нём меньше, чем в генераторном газе.
В связи с превращением казенного угля в газообразное топливо необходимо отметить впервые высказанные Д. И. Менделеевым в 1888 г. мысли о подземной его газификации.
Эти мысли потом блестяще были развиты В. И. Лениным и впервые в мире осуществлены у нас в 1937 г.
Часто задаваемые вопросы:
Да, углерод — это амфотерный элемент, то есть он может выступать и как окислитель, и как восстановитель.
Это зависит от того, с каким элементом он взаимодействует.
Углерод — сильный восстановитель, особенно при высоких температурах.
Он широко используется в металлургии для восстановления металлов из их оксидов.
Например: в доменных печах углерод (в виде кокса) восстанавливает оксид железа, забирая у него кислород и восстанавливая железо до чистого металла
Углерод проявляет свойства окислителя в реакциях с менее электроотрицательными элементами.
Например: при взаимодействии с активными металлами или водородом.



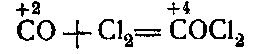
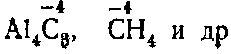
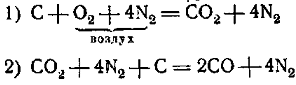
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.