Восстановитель это химические вещества, которые проявляют себя в химических реакциях как восстановитель, причем эти вещества окисляются.
Примером восстановительной реакции можно считать углерод С, в получении железа из его оксида. А также электрический ток, причем он может быть как восстановитель и окислитель.
Что такое восстановитель в химии
Восстановителями могут быть и нейтральные атомы, и ионы.
Восстановителями называются атомы, которые свои электроны способны отдавать другим атомам, переходя при этом в положительно заряженные ионы (в наружном электронном слое они имеют один, два или три электрона).
Восстановителями в соответствующих условиях могут быть атомы всех элементов, кроме атомов инертных газов и фтора.
Рис. Перекись водорода как восстановитель.
В химии восстановители называют атомы таких элементов, которые сравнительно легко теряют свои электроны, т. е. атомы с малым ионизационным потенциалом.
К таким элементам относятся элементы двух первых подгрупп периодической системы элементов Менделеева (щелочные и щёлочно-земельные металлы).
Ионизационный потенциал, как правило, падает с увеличением радиуса атома, а поэтому одновременно с этим и растёт его восстановительная способность.
В главных подгруппах периодической системы элементов Менделеева восстановительная способность нейтральных атомов растёт с увеличением радиуса атома.
Отрицательно заряженные ионы
Все отрицательно заряженные ионы являются восстановителями, так как они могут терять свои избыточные электроны.
Эта способность отрицательно заряженных ионов при одинаковом заряде растёт с увеличением радиуса атома.
Отсюда следует, что в группе галогенов ион J-1 обладает большей восстановительной способностью, чем ионы Вr-1 и Сl-1, и притом настолько большей, что практически его относят к группе восстановителей.
Ионы же Сl-1 и Вr-1 могут реагировать как восстановители лишь в исключительных случаях, a F-1 при химических реакциях восстановительные свойства совсем не проявляет.
Вообще в группе галогенов восстановительная способность отрицательно заряженных ионов растёт с увеличением заряда ядра. Положительно заряженные ионы металлов и неметаллов
Положительно заряженные ионы могут проявлять свои восстановительные свойства в том случае, если они переходят из иона низшей в ион высшей положительной зарядности.
Например:
Сr+3 может отдать 3е и перейти в Сr+6(вернее, в Сr»4 или Сr2O»7);
Sn+2 „ 2ē „ Sn+4 (в щелочном растворе SnO»3 или SnO»4»); S+4 „ 2ē „ S+6 (в SO»4).
Таким образом, восстановителями могут быть:
а) Нейтральные атомы,
б) Отрицательно заряженные ионы,
в) Положительно заряженные ионы, способные переходить в ионы более высокой положительной зарядности.
Восстановители
В технике имеют большое значение следующие восстановители:
1) Углерод,
2) Окись углерода,
3) Железо, цинк, алюминий, олово и натрий,
4) Сернистая кислота,
5) Сульфит и бисульфит натрия,
6) Сернистый натрий,
8) Водород,
9) Электрический ток.
В лабораторной практике в качестве восстановителей применяются, главным образом, следующие кислоты и их соли в кислом или щелочном растворе:
1) Сернистая (H2SO3),
2) Йодистоводородная (HJ),
3) Сероводородная (H2S),
4) Фосфористая (Н3РO3),
а также
5) Гидразин (N2H4),
6) Гидроксиламин (NH2OH),
7) Соединения двухвалентного олова,
8) Водород в момент его выделения.
Статья на тему Восстановитель

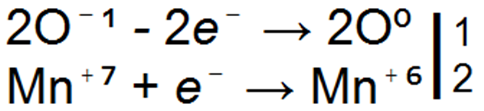
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.