Теория:
Сера (S) — типичный неметалл, чье химическое поведение полностью определяется его положением в Периодической таблице.
Идентификация серы основана на двух фундаментальных константах:
- Атомном номере (Z=16), который определяет электронную конфигурацию (1s2 . . . 3p4).
- Местоположении в 3-м периоде и 16-й группе (VI A).
Это положение диктует все производные свойства элемента — от наличия шести валентных электронов до всего диапазона степеней окисления серы (от 2 до +6).
Как определить положение серы в Таблице Менделеева
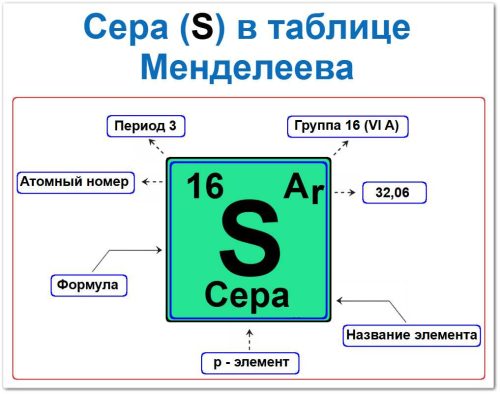
Положение элемента в таблице задаётся тремя фундаментальными характеристиками — своего рода «химическим паспортом»:
- Порядковый номер и атомный номер.
- Название элемента.
- Группа (вертикальный столбец).
- Период (горизонтальный ряд).
- Электронный блок, (p‑элемент).
Порядковый номер / Атомный номер (Z = 16)
Роль в идентификации: Атомный номер 16 — уникальный идентификатор серы. Он означает, что в ядре атома содержится ровно 16 протонов (p⁺).
Влияние на свойства: Z = 16 определяет, что нейтральный атом серы имеет 16 электронов (e⁻).
Это задаёт электронную конфигурацию: 1s2 2s2 2p6 3s2 3p4, которая лежит в основе всех химических свойств элемента.
Важное: Без знания Z невозможно однозначно идентифицировать элемент.
Примечание: Изотопы серы (32S, 33S, 34S, 36S) имеют разное число нейтронов, но одинаковый Z = 16, поэтому химически ведут себя одинаково.
Название элемента («Сера»)
Роль в идентификации: Название «Сера» — общепринятый лингвистический идентификатор для элемента с Z = 16.
Влияние на свойства: Само название не влияет на химические или физические свойства. Оно лишь присваивается элементу с данным атомным номером.
Важное: В международной номенклатуре используется символ S (от лат. Sulfur).
Примечание: Название отражает историческое использование вещества (например, «серный дым» в обрядах), но не раскрывает его химических особенностей.
Группа (16‑я / VI A)
Роль в идентификации: Положение в 16‑й группе (VI A) означает, что у серы 6 валентных электронов (3s2 3p4) на внешнем уровне.
Влияние на свойства: Группа определяет диапазон степеней окисления:
-
Максимальная СО = +6 (например, H2SO4, SO3).
-
Минимальная СО = –2 (например, H2S, Na2S).
-
Возможны промежуточные СО: +4 (SO2, H2SO3), 0 (S8).
Важное: Число валентных электронов напрямую задаёт химическую активность и типичные реакции серы.
Примечание: Элементы 16‑й группы (халькогены) имеют схожие тенденции в изменении свойств (O, S, Se, Te, Po).
Период (3‑й / горизонтальный ряд)
Роль в идентификации: Положение в 3‑м периоде означает, что атом серы имеет три энергетических уровня (оболочки: K, L, M).
Влияние на свойства: Наличие трёх электронных слоёв указывает на существование свободных 3d‑орбиталей.
Благодаря этому:
-
Сера может проявлять переменную валентность (II, IV, VI).
-
В возбуждённом состоянии электроны могут переходить на 3d‑орбитали, увеличивая число неспаренных электронов.
-
Это отличает серу от кислорода (2‑й период, нет d‑орбиталей).
Важное: Период определяет размер атома и энергию связи электронов.
Примечание: Радиус атома серы (104 пм) больше, чем у кислорода (66 пм), что облегчает отдачу электронов.
p‑элемент (электронное семейство)
Роль в идентификации: Сера — p‑элемент, то есть последний электрон находится на p‑подуровне (3p4).
Влияние на свойства:
-
Сера — типичный неметалл с высокой электроотрицательностью (2,58 по Полингу).
-
Склонна образовывать ковалентные связи (например, SO2, H2S).
-
Может формировать гомоатомные цепи (S₈ — ромбическая сера).
-
Обладает окислительно‑восстановительной двойственностью: может быть и окислителем (H2S), и восстановителем (SO2).
Важное: Принадлежность к p‑блоку (группы 13–18) объясняет общие тенденции: рост неметалличности слева направо в периоде.
Все значения для всех элементов можно узнать в таблице атомных масс.
Примечание: В отличие от s‑элементов (металлов), p‑элементы чаще образуют молекулярные, а не ионные соединения.
Проверка знаний: Как определить серу по таблице Менделеева
Отметьте три правильных утверждения, которые однозначно определяют серу (S) в Периодической системе.
По каким признакам можно безошибочно установить, что речь идёт именно о сере?
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) В атомном ядре содержится ровно 16 протонов.
Это главный отличительный признак: число протонов однозначно задаёт химический элемент.- три электронных слоя (период 3);
- шесть электронов на внешней оболочке (группа 16);
- принадлежность к семейству халькогенов.
- 2) Находится в третьем периоде и 16‑й группе (VI A).
Такое положение в таблице определяет: - 3) Полный набор электронов: 1s2 2s2 2p6 3s2 3p4.
— Общее число электронов (16) совпадает с атомным номером.
— На внешнем уровне (n = 3) — 6 электронов (3s2 3p4).
— Краткая запись: [Ne] 3s2 3p4. - 4) Внешний электронный слой полностью заполнен (8 электронов).
Ошибка: у серы на внешнем уровне 6 электронов; октет характерен только для благородных газов. - 5) Обладает тремя электронными оболочками.
Хотя это верно, признак не уникален: все элементы 3‑го периода (от Na до Ar) имеют три слоя. - 6) Может проявлять исключительно положительные степени окисления +4 и +6.
Неверно: сера имеет степени окисления −2 (в H₂S), 0 (в S₈), +4 (в SO₂) и +6 (в SO₃, H₂SO₄).
Часто задаваемые вопросы:
16. Это число протонов в ядре; однозначно идентифицирует серу.
В 3‑м периоде, 16‑й группе (по ИЮПАК) / VIA (по старой номенклатуре). Это задаёт:
3 энергетических уровня;
6 валентных электронов на внешнем уровне.
Полная: 1s22s22p63s23p4.
Сокращённая: [Ne]3s23p4.
Это объясняет её типичные степени окисления (−2, +4, +6) и переменную валентность (II/IV/VI).

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.