Теория:
На практике элемент — это не загадка. За каждым символом в таблице Менделеева стоит чёткая система свойств, которую можно последовательно расшифровать.
Для этого опираемся на надёжные законы химии, проверенные десятилетиями.
В этом подробном руководстве предлагается единый, безошибочный алгоритм идентификации любого элемента, базирующийся на следующих ключевых инструментах:
- Периодическая таблица (для определения положения и общих свойств).
- Электронная формула (для понимания строения атома и валентности).
- Валентность и Степень Окисления (для прогнозирования типов связей и формул соединений).
- Электроотрицательность (для предсказания полярности и типа связи).
- Таблица атомных масс (для финальной идентификации и расчетов).
Идём от простого к сложному: от номера в таблице — к электронной структуре, от валентности — к типам связей, от электроотрицательности — к полярности, от атомной массы — к точным расчётам.
Так мы полностью «прочитываем» элемент.
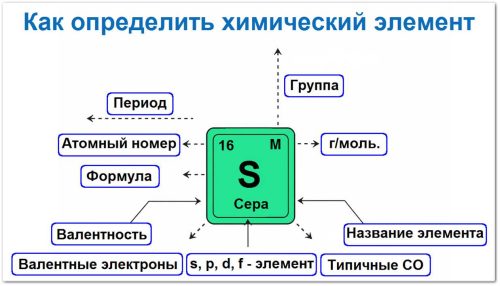
Первый взгляд: где он живёт в таблице?
Открываем Периодическую систему и находим нужный элемент. Сразу обращаем внимание на три вещи: порядковый номер, период (строка) и группу (столбец).
-
Порядковый номер — это, по сути, «идентификатор»: он показывает число протонов в ядре и (в нейтральном атоме) число электронов.
-
Период говорит, сколько у атома электронных слоёв — чем больше число, тем «объёмнее» атом.
-
Группа (для главных подгрупп) подсказывает, сколько электронов сидит на внешнем уровне — именно они отвечают за химические связи.
Уже здесь можно сделать первые выводы о характере элемента. Если он слева и внизу таблицы — скорее всего металл, который охотно отдаёт электроны.
Если справа и вверху — неметалл, который предпочитает их забирать.
А ещё есть деление на блоки (s, p, d, f), которое намекает, как именно атом будет взаимодействовать с соседями.
Второй шаг: заглядываем внутрь — электронная формула
Это как схема устройства атома: где и сколько электронов «сидят». На первый взгляд — набор букв и цифр, но если присмотреться, всё становится понятно.
Открываем нужную Вам электронную формулу элемента.
Например, запись 1s2 2s2 2p4 — это не абракадабра, а чёткая информация:
-
Суммируем верхние индексы (2 + 2 + 4) — получаем атомный номер Z = 6.
-
Самое большое число перед буквой (n = 2) — это номер периода.
-
Электроны на внешнем уровне (s + p) — это номер группы для главных подгрупп. Для переходных металлов придётся учитывать ещё и d-электроны.
Третий шаг: сколько «рук» у атома — валентность
Представьте, что электроны — это руки, которыми атом «цепляется» за другие атомы.
Число таких «рук» и есть валентность.
У s— и p-элементов всё просто: максимум обычно совпадает с номером группы.
А вот d-металлы хитрее — они могут подключать электроны с разных уровней, поэтому их валентность меняется в зависимости от ситуации.
Четвёртый шаг: условный заряд — степень окисления
Степень окисления — это как «социальный статус» атома в соединении: условный заряд, который он получает, если представить, что все связи ионные.
Здесь есть простые правила‑подсказки:
-
Максимальная степень окисления чаще всего равна номеру группы.
-
Минимальная (для неметаллов) вычисляется как 8 − номер группы.
-
А вот промежуточные значения — это уже «визитная карточка» элемента. Например, ванадий с его +4 сразу выделяется на фоне других.
Пятый шаг: кто «главный» по электронам — электроотрицательность
Чем правее и выше элемент в таблице, тем сильнее он тянет к себе электроны. Это и есть электроотрицательность (ЭО).
Зачем это знать?
-
Если ЭО низкая, атом скорее отдаст электроны (классическое поведение металлов).
-
Если высокая — будет их притягивать (так ведут себя неметаллы).
-
Разница в ЭО между двумя атомами подскажет, какая связь получится: ионная, ковалентная, и насколько она будет полярной.
Финальный штрих: атомная масса
На первый взгляд, это просто число в ячейке таблицы атомных масс. Но на деле — ключ к расчётам:
-
Без неё не посчитать молярную массу вещества.
-
Она нужна, чтобы понять, сколько реагента взять и сколько продукта получится в реакции.
Итак, как действовать?
Всё просто:
-
Находим элемент в таблице — запоминаем номер, период, группу.
-
Выписываем электронную формулу — считаем электроны, определяем уровни.
-
Думаем о валентности — сколько связей может образовать атом.
-
Оцениваем возможные степени окисления — как элемент будет вести себя в соединениях.
-
Смотрим на электроотрицательность — понимаем, кто в паре «главный» по электронам.
-
Берём атомную массу — готовимся к расчётам.
Вот и всё. Никакой магии — только логика и наблюдательность. Каждый элемент действительно «говорит» с нами через свои параметры. Нужно лишь научиться слушать.
Часто задаваемые вопросы:
Атомный номер (Z), который равен числу протонов в ядре. (Определяет порядковый номер, период и группу.)
По номеру группы и электронной конфигурации. (Максимальная СО = номер группы; минимальная СО неметаллов = 8 — Номер группы.
Пользуйтесь «правилом угла»:
Чем правее и выше элемент в Периодической таблице, тем выше его электроотрицательность.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.