Теория:
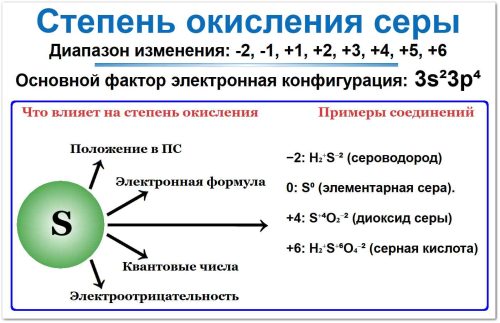
Степень окисления серы варьируется от −2 до +6, то есть -2, -1, 0, +1, +2, +3, +4, +5, +6.
Заметим, что положительные и отрицательные значения бывают только степеней окисления (СО), а валентность может быть только положительной без знака +.
Это обусловлено её положением в 16‑й группе (VIA) Периодической системы и электронной конфигурацией 3s2 3p4 (6 валентных электронов).
При этом сера обладает умеренной электроотрицательностью (2,58 по Полингу).
Определить степень окисления (СО) серы можно, опираясь на базовые правила химии и при необходимости — на структурный анализ.
Как определить степень окисления серы
Определить степень окисления (СО) серы (S) можно, используя комплексный подход, который включает анализ её фундаментальных свойств (положения в периодической системе, электроотрицательности, электронной структуры) и практический расчёт по формуле соединения.
Положение в Периодической системе
Сера расположена в 3‑м периоде и 16‑й группе (главная подгруппа, VIA). Это определяет её крайние степени окисления:
-
Высшая (максимальная) СО: равна номеру группы (+6). Пример — серная кислота H₂SO₄.
-
Низшая (минимальная) СО: рассчитывается как 8 − номер группы = −2. Пример — сероводород H₂S.
Примечание: правило «8 − номер группы» работает для неметаллов главных подгрупп и отражает потребность в электронах для завершения внешнего октета.
Электронная конфигурация
Валентный электронный слой серы имеет конфигурацию 3s² 3p⁴ (всего 6 валентных электронов). Это объясняет:
-
СО = −2: сера принимает 2 электрона для достижения стабильной конфигурации аргона.
-
СО = +6: сера отдаёт все 6 валентных электронов в соединениях с более электроотрицательными элементами.
Квантовые числа и возможность возбуждения
Наличие свободных 3d‑орбиталей (при n = 3, l = 2) позволяет электронам с 3s‑ и 3p‑орбиталей переходить на 3d‑уровень при возбуждении. Это приводит к:
-
распариванию электронов;
-
увеличению числа неспаренных электронов (до 4 или 6);
-
возможности проявления степеней окисления +4 и +6.
Пример расчёта суммы орбитальных квантовых чисел (l) для валентных электронов серы:
-
Для 3s²: l = 0 у каждого электрона → сумма = 0 + 0 = 0.
-
Для 3p⁴: l = 1 у каждого электрона → сумма = 1 + 1 + 1 + 1 = 4.
-
Общая сумма l = 0 + 4 = 4.
Электроотрицательность (ЭО)
Электроотрицательность серы (≈ 2,58 по Полингу) определяет знак степени окисления в соединениях:
-
СО = −2: сера притягивает электроны в соединениях с менее электроотрицательными элементами (например, H в H2S, металлы в сульфидах).
-
СО = +4 / +6: сера отдаёт электроны в соединениях с более электроотрицательными элементами (прежде всего O в SO2, SO3, H2SO4).
Важно: разница в ЭО между серой и партнёром по связи определяет направление смещения электронной плотности и, следовательно, знак СО.
Расчёт степеней окисления по формулам соединений
Основной практический метод — использование правила: сумма степеней окисления всех атомов в нейтральной молекуле равна нулю.
Пример: диоксид серы (SO2)
-
Известная СО кислорода в оксидах: −2.
-
Обозначим СО серы как x.
-
Составим уравнение:
-
Решим:
-
Вывод: степень окисления серы в SO₂ равна +4.
Почему сера проявляет степень окисления от -2 до +6
Сера (S) демонстрирует диапазон степеней окисления (СО) от −2 до +6 благодаря положению в Периодической системе и особенностям электронной структуры.
Электронная структура и крайние значения СО
-
Положение в ПС: 16‑я группа (VIA), 3‑й период.
-
Электронная конфигурация: 3s² 3p⁴ (6 валентных электронов).
Низшая СО (−2)
-
Для достижения стабильной конфигурации благородного газа (аргона) сере нужно принять 2 электрона.
-
Это происходит в соединениях с менее электроотрицательными элементами:
-
металлы (Na2S — сульфид натрия);
-
водород (H2S — сероводород).
-
-
Итог: −2 — типичная степень окисления в сульфидах.
Высшая СО (+6)
-
Сера может отдать все 6 валентных электронов при взаимодействии с более электроотрицательными элементами (прежде всего кислородом и фтором).
-
Примеры:
-
H2SO4 (серная кислота);
-
SO3 (оксид серы(VI)).
-
-
Итог: +6 — высшая возможная степень окисления серы.
Роль 3d‑орбиталей (квантово‑механическое обоснование)
-
В 3‑м периоде у серы появляются свободные 3d‑орбитали (n = 3, l = 2).
-
В возбуждённом состоянии электроны с 3s‑ и 3p‑орбиталей могут распариваться и переходить на 3d‑орбитали.
-
Это увеличивает число неспаренных электронов:
-
4 неспаренных → СО = +4 (например, в SO2, H2SO4);
-
6 неспаренных → СО = +6 (например, в SO3, H2SO4).
-
Вывод: наличие 3d‑орбиталей позволяет сере проявлять положительные степени окисления вплоть до +6.
Влияние электроотрицательности (ЭО)
-
ЭО серы: ≈ 2,58 (по Полингу) — промежуточное значение.
-
Если партнёр менее электроотрицателен (H, Na, металлы):
-
сера принимает электроны → СО = −2.
-
-
Если партнёр более электроотрицателен (O, F):
-
сера отдаёт электроны → СО = +4 или +6.
-
Окислительно‑восстановительная двойственность
Сера проявляет:
-
окислительные свойства (принимает электроны) при СО = −2;
-
восстановительные свойства (отдаёт электроны) при СО = +4, +6.
Это делает её активным участником окислительно‑восстановительных реакций, где она может как окисляться, так и восстанавливаться.
Примеры соединений серы с разными степенями окисления
Низшая степень окисления (СО = -2)
- Сероводород: H2S
- Сульфид натрия: Na2S
- Сульфид железа(II): FeS
Нулевая Степень Окисления (СО = 0)
- Молекулярная сера (элементарная): S (часто S8)
Промежуточная Степень Окисления (СО = +4)
- Диоксид серы (Сернистый газ): SO2
- Сернистая кислота: H2SO3
- Сульфит калия: K2SO3
Высшая Степень Окисления (СО = +6)
- Триоксид серы (Серный ангидрид): SO3
- Серная кислота: H2SO4
- Сульфат бария: BaSO4
Пример решения, задача:
▶️ Дано:
Соединение диоксид серы (SO2).
⌕ Найти:
Определите валентность (V) и степень окисления (СО) в соединении.
✨ Решение:
Используем правило: сумма степеней окисления всех атомов в нейтральной молекуле равна нулю.
-
Устанавливаем известную степень окисления (СО) кислорода: СО(O) = −2 (в оксидах).
-
Обозначаем искомую степень окисления серы как x.
-
Составляем и решаем уравнение:
x + 2 · (СО(O)) = 0
x + 2 · (−2) = 0
x − 4 = 0
x = +4
✅ Ответ:
Степень окисления серы в диоксид серы (SO2) равна +4.
Часто задаваемые вопросы:
Основные: −2, 0, +4, +6.
Реже: +2, −1 (в дисульфидах, напр. FeS2).
Очень редко/нехарактерно: +1, +3, +5.
−2: сера принимает 2 электрона (завершает внешний уровень, как в H2S).
0: элементарная сера (S8).
+4 и +6: отдаёт 4 или 6 электронов благодаря вакантным 3d‑орбиталям (напр., SO2, H2SO4).
Промежуточные значения связаны с электронным строением (3s2 3p4) и электроотрицательностью серы (~2,58).
СО = −2 (H2S): сильный восстановитель (легко окисляется до S0, S+4, S+6).
СО = 0 (S8): может быть и окислителем, и восстановителем.
СО = +4 (SO2): и окислитель, и восстановитель.
СО = +6 (H2SO4): сильный окислитель.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.