Теория:
Кислород (O) — типичный неметалл, чьё химическое поведение полностью определяется его положением в Периодической таблице.
Идентификация кислорода основана на двух фундаментальных константах:
-
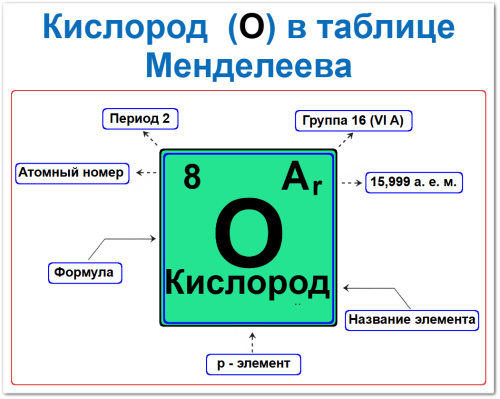
Атомный номер Z = 8, который задаёт электронную конфигурацию: 1s2 2s2 2p4.
-
Местоположение: 2‑й период и 16‑я группа (VI A).
Это положение объясняет:
-
наличие шести валентных электронов;
-
диапазон степеней окисления кислорода от –2 до +2.
Важные следствия
-
Доминирующая степень окисления: –2, так как кислород является вторым самым электроотрицательным элементом и стремится принять два электрона для завершения внешней оболочки.
-
Ограничение валентности: нахождение во 2‑м периоде означает отсутствие d‑орбиталей, что строго ограничивает максимальную валентность кислорода значением II.
Как определить положение кислорода в Таблице Менделеева
Положение элемента в таблице задаётся несколькими фундаментальными характеристиками — своего рода «химическим паспортом»:
- Порядковый номер и атомный номер.
- Название элемента.
- Группа (вертикальный столбец).
- Период (горизонтальный ряд).
- Электронный блок, (p‑элемент).
Порядковый номер / Атомный номер кислорода
Роль в идентификации: атомный номер 8 — уникальный идентификатор Кислорода. Он означает, что в ядре атома содержится ровно 8 протонов (p+).
Влияние на свойства: Z = 8 определяет, что нейтральный атом Кислорода имеет 8 электронов (e⁻).
Это задаёт электронную конфигурацию: 1s2 2s2 2p4, которая лежит в основе всех химических свойств элемента.
Важно: без знания атомного номера невозможно однозначно идентифицировать элемент.
Примечание: основные изотопы Кислорода (16O, 17O, 18O) имеют разное число нейтронов (8, 9 и 10 соответственно), но одинаковый атомный номер Z = 8, поэтому химически ведут себя одинаково.
Название элемента («Кислород»)
Роль в идентификации: название «Кислород» — общепринятый лингвистический идентификатор для элемента с атомным номером 8.
Влияние на свойства: само название не влияет на химические или физические свойства. Оно лишь присваивается элементу с данным атомным номером.
Важно: в международной номенклатуре используется символ O (от лат. Oxygenium).
Примечание: название «Кислород» (др. греч. «порождающий кислоты») было дано французским химиком Лавуазье, поскольку считалось, что он входит в состав всех кислот.
Группа (16‑я / VI A)
Роль в идентификации: Положение в 16‑й группе (VI A) означает, что у Кислорода 6 валентных электронов (2s2 2p4) на внешнем уровне.
Влияние на свойства: Группа определяет диапазон степеней окисления:
-
Максимальная СО: теоретически +6 (равна номеру группы VI A), но практически не реализуется из‑за отсутствия d‑орбиталей и высокой электроотрицательности. Реально максимально положительная СО — +2 (только в соединении OF₂).
-
Минимальная СО: –2 (рассчитывается как 6 – 8 = –2). Это самая стабильная и доминирующая степень окисления Кислорода в большинстве соединений (например, H2O, Na2O).
-
Промежуточные СО: –1 (в пероксидах, H2O2) и –½ (в супероксидах, KO2).
Важное: Кислород является вторым самым электроотрицательным элементом после Фтора, что делает его крайне активным окислителем.
Число валентных электронов напрямую задаёт его высокую химическую активность.
Примечание: Кислород — первый элемент в 16‑й группе (халькогены).
Из‑за малого размера и отсутствия d‑орбиталей он имеет наиболее жёсткие ограничения по валентности и степеням окисления по сравнению с другими элементами этой группы (S, Se, Te).
Период (2‑й / Горизонтальный ряд)
Роль в идентификации: Положение во 2‑м периоде означает, что атом Кислорода имеет два энергетических уровня (оболочки: K, L).
Влияние на свойства: Наличие только двух электронных слоёв является критическим фактором, определяющим химическое поведение Кислорода, поскольку указывает на отсутствие свободных d‑орбиталей.
Следствия (главные отличия от Серы):
-
Отсутствие d‑орбиталей: Кислород не имеет возможности перехода в возбуждённое состояние, то есть он не может распаривать электроны и использовать дополнительные орбитали.
-
Валентность: Максимальная валентность Кислорода строго ограничена II. Он не может проявлять валентности IV или VI.
-
Размер: Малый размер атома обеспечивает очень высокую энергию ионизации и высочайшую электроотрицательность (после Фтора).
Важное: Период определяет размер атома и, следовательно, энергию, необходимую для отрыва или присоединения электронов.
Кислород — самый яркий неметалл в своей группе, что объясняется его малым радиусом, определяемым 2‑м периодом.
Примечание: Радиус атома Кислорода (≈ 66 пм) намного меньше, чем у Серы (≈ 104 пм). Это объясняет, почему Кислород является более сильным окислителем, чем Сера.
Относительная атомная масса Кислорода (Ar ≈ 15,999 а.е.м.)
Роль в идентификации Атомная масса (Ar) — это среднее значение массы природных изотопов элемента, выраженное в атомных единицах массы.
Для Кислорода она равна примерно 15,999 а.е.м., что округляется до 16.
Влияние на положение в таблице
-
Историческая роль: до открытия протона и атомного номера (Z) элементы располагались в таблице Менделеева по возрастанию атомных масс.
-
Современная роль: сегодня атомная масса используется для:
-
Расчётов в химии (например, молярной массы);
-
Подтверждения положения элемента (для лёгких элементов она примерно равна удвоенному Z).
-
Все значения для всех элементов можно узнать в таблице атомных масс.
Важно Атомная масса не может служить уникальным идентификатором, потому что у него существуют изотопы, бывают нарушения порядка.
p‑Элемент (электронное семейство)
Роль в идентификации: Кислород — p‑элемент, то есть последний электрон находится на p‑подуровне (2p4).
Влияние на свойства:
-
Кислород — типичный неметалл с самой высокой электроотрицательностью после Фтора (≈ 3,44 по Полингу).
-
Склонен образовывать ковалентные связи (например, H2O, CO2).
-
Может формировать аллотропную модификацию — озон (O3), а также двухатомную молекулу (O2).
-
Обладает сильной окислительной способностью и, за исключением OF2, в соединениях проявляет только отрицательные степени окисления.
Важное: Принадлежность к p‑блоку (группы 13–18) объясняет общие тенденции: Кислород находится в правой части таблицы (кроме галогенов и инертных газов), что обуславливает его ярко выраженный неметаллический характер и высокую реакционную способность.
Примечание: В отличие от s‑элементов (металлов), p‑элементы, такие как Кислород, чаще образуют молекулярные, а не ионные соединения. Их способность к образованию ковалентных связей лежит в основе органической химии.
Проверка знаний: Как определить кислород по таблице Менделеева
Отметьте три правильных утверждения, которые однозначно определяют Кислород (O) в Периодической системе.
По каким признакам можно безошибочно установить, что речь идёт именно о Кислороде?
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) В атомном ядре содержится ровно 8 протонов.
Это главный отличительный признак: число протонов (Z = 8) однозначно задаёт химический элемент. - 2) Находится во втором периоде и 16-й группе (VI A).
Такое сочетание положения в таблице является уникальным для Кислорода и определяет:- две электронных оболочки (период 2);
- шесть валентных электронов (группа 16);
- принадлежность к семейству халькогенов.
- 3) Полный набор электронов: 1s2 2s2 2p4.
— Общее число электронов (8) совпадает с атомным номером (Z = 8).
— На внешнем уровне (n = 2) — 6 электронов (2s22p4).
— Краткая запись: [He] 2s22p4. - 4) Обладает тремя электронными оболочками.
Ошибка: Кислород находится во 2-м периоде и имеет только две оболочки. - 5) Является самым электроотрицательным элементом в своей группе.
Хотя это верно (электроотрицательность уменьшается сверху вниз), этот признак не уникален: все верхние элементы группы являются самыми электроотрицательными в своих группах. - 6) Может проявлять исключительно положительные степени окисления.
Неверно: Кислород почти всегда проявляет отрицательную степень окисления –2 (например, в H2O).
Часто задаваемые вопросы:
Z = 8. Это 8 протонов в ядре, что однозначно определяет элемент.
Во 2-м периоде и 16-й группе (VI A).
-2. Это связано с его высокой электроотрицательностью и стремлением принять 2 электрона (2p4 → 2p6).

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.