S сера (Sulfur) — химический элемент 16-й группы, с порядковым номером 16 в периодической системе. Находится в третьем периоде.
Температура плавления: 113 ℃. Плотность: 2.06 г/см3.
В жидкой серой образуется пи-модификация по схеме λ — S ⇄ μ — S + π — S. Ее можно отделить от мю-серы, используя меньшую растворимость в сероуглероде.
В процессе хранения пи-модификация превращается в мю-серу. При быстром охлаждении раствора серы в бензоле или спирте выделяется твердая нестабильная гамма-модификация.
У ромбической и моноклинной серы, лямбда-серы и пи модификации — восьми-звенное кольцеобразное пространственное строение, у мю-серы — открытые цепочки.
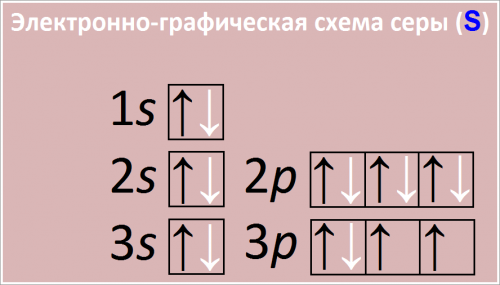
Электронная формула
Электронная формула атома серы:
1s2 2s2 2p6 3s2 3p4
Сокращенная электронная конфигурация S:
[Ne] 3s2 3p4
Электронно-графическая схема серы (S)
Рис. Схема распределения электронов по атомным орбиталям в атоме сера.
Энергетические уровни
Распределение электронов по энергетическим уровням в атоме S:
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 6
Рис. Распределение электронов по энергетическим уровням в атоме сера S.
Валентные электроны серы
Количество валентных электронов в атоме серы — 6.
Таблица квантовых чисел серы (N — главное, L — орбитальное, M — магнитное, S — спин).
| Орбиталь | N | L | M | S |
| s | 3 | 0 | 0 | +1/2 |
| s | 3 | 0 | 0 | -1/2 |
| p | 3 | 1 | -1 | +1/2 |
| p | 3 | 1 | 0 | +1/2 |
| p | 3 | 1 | 1 | +1/2 |
| p | 3 | 1 | -1 | -1/2 |
Степень окисления серы равна: −2 −1 +1 +2 +3 +4 +5 +6
Стабильные изотопы
| Изотоп | Протоны | Нейтроны | Атомная масса изотопа |
| 32S | 16 | 16 | ~30.97376163 |
| 33S | 16 | 17 | ~32.97145876 |
| 34S | 16 | 18 | ~33.9678669 |
| 36S | 16 | 20 | ~35.96708076 |
Природная сера состоит из стабильных изотопов 32S (95,02%), 33S (0,75%), 34S (4,21%) и 36S (0,02%).
Известны искусственные радиоактивные изотопы 29S, 30S, 31S, 36S, 37S и 38S с периодами полураспада соответственно 0,195; 1,35 и 2,40— 3,18 сек; 87,9 дней; 5,04 и 172 мин.


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.