Теория:
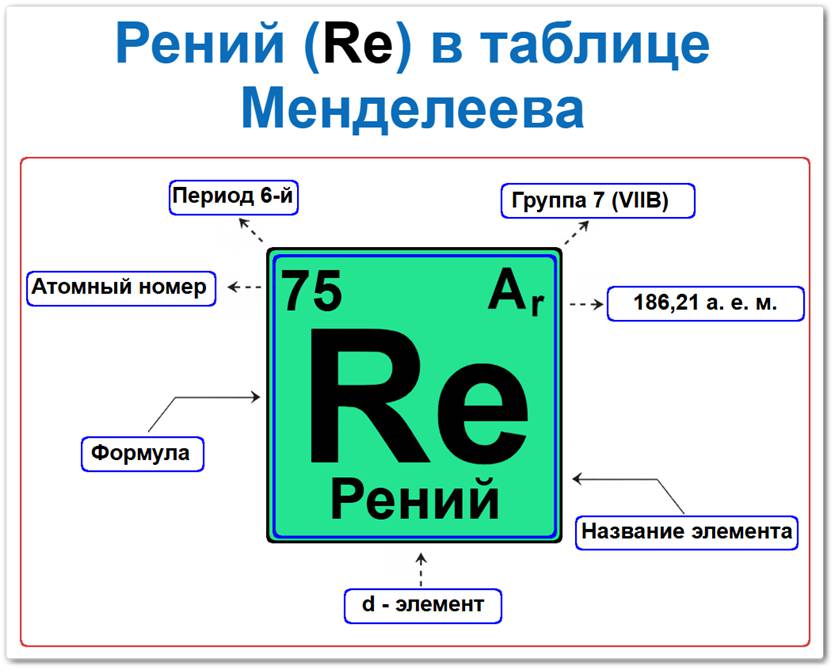
Рений (Re) в периодической системе: 6‑й период, 7‑я группа (по устаревшей классификации —VII B), атомная масса 186,207 а.е.м.
Занимает стратегическое положение в 6‑м периоде, что делает его одним из самых редких, тугоплавких и плотных металлов в земной коре.
Будучи химическим гомологом (аналогом) марганца и технеция, он располагается в центре ряда переходных металлов своего периода.
Благодаря высокой энергии связи между атомами, рений обладает феноменальной температурой плавления (3186°C), уступая по этому показателю только вольфраму и углероду.
А его нахождение в 7‑й группе (ранее — побочная подгруппа VII группы) задает ключевые параметры:
Широчайший диапазон степеней окисления: от -1 до +7 (наиболее устойчива +7).
А также уникальную способность образовывать кратные связи металл-металл в кластерных соединениях, таких как [Re2Cl8]2-.
Структура атома подтверждается её электронной формулой (конфигурацией):
[Xe] 4f14 5d5 6s2.
На которой наглядно можно определить её положение как типичного d-блочного элемента, находящегося в середине 5d-подуровня.
Рений в таблице Менделеева можно определить на основании закона периодичности: положение в группе (7 / VII B) и периоде (6-й), а также порядкового номера / атомный номер (Z = 75).
Как определить положение Рения в Таблице Менделеева
Локация рения в таблице описывается характеристиками его атомного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (вертикальный ряд, семейство марганца).
- Период (горизонтальный ряд).
- Электронное семейство (рений — d‑элемент).
Порядковый номер / атомный номер (Z = 75)
- Служит уникальным кодом элемента в системе.
- В ядре — 75 протонов; в нейтральной оболочке — 75 электронов.
- Электронное строение: [Xe] 4f14 5d5 6s2.
Важно: Наличие пяти неспаренных электронов на 5d-подуровне позволяет рению проявлять множество валентных состояний и участвовать в образовании сверхпрочных сплавов.
Название и символ
- Название: «рений» (лат. Rhenium, в честь Рейнской провинции в Германии).
- Символ: Re.
- Примечание: Был предсказан Менделеевым как «двимарганец», но открыт только в 1925 году, став последним найденным стабильным элементом в природе.
Группа (7 / VII B)
Расположен в 7‑й группе; по классической классификации — побочная подгруппа VII группы (подгруппа марганца).
Химический потенциал:
- Валентность рения: варьируется от I до VII, наиболее характерна VII.
- Степень окисления: +7 является наиболее стабильной (например, в оксиде Re2O7 или перренате калия KReO4).
Период (6‑й)
Находится в 6‑м периоде — его электроны распределены по шести энергетическим уровням.
Влияние на свойства:
- Лантаноидное сжатие: Благодаря заполнению 4f-подуровня, атомный радиус рения невелик, что обуславливает его колоссальную плотность (21,02 г/см³).
- Жаропрочность: Положение в 6-м периоде обеспечивает прочную металлическую связь, что делает рений незаменимым в авиационных двигателях.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(Re) ≈ 186,207 а.е.м.
- Определение: средневзвешенное значение массы двух природных изотопов (стабильного Re-185 и долгоживущего слаборадиоактивного Re-187).
Все значения для всех элементов можно узнать в таблице атомных масс.
d‑Элемент (электронное семейство)
Застраивающимся является 5d‑подуровнь (5d5).
Специфика блока: Будучи d-элементом середины блока, рений обладает высокой каталитической активностью и способностью образовывать комплексные соединения сложной структуры.
Определение энергетических уровней Рения по Таблице Менделеева
Положение Рения (Re) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 6-й период (Количество этажей)
Рений находится в шестой строке таблицы. Номер периода определяет число электронных слоев.
- Итог: У Рения 6 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Рения — 75. Его 75 электронов распределены по уровням следующим образом:
Re ) 2 ) 8 ) 18 ) 32 ) 13 ) 2
3. 7-я группа (Химический характер)
Рений возглавляет нижнюю часть подгруппы марганца.
- d-элемент: Свойства определяются пятью 5d-электронами.
- Место в блоке: Находится между вольфрамом (W) и осмием (Os), разделяя с ними экстремальную твердость и тугоплавкость.
Проверка знаний: Как определить рений по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Рений (Re) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 75. Уникальный идентификатор рения.
- 2) 6-й период, 7-я группа. Указывает на принадлежность к тяжелым d-металлам.
- 3) Тугоплавкость. Физическое свойство, обусловленное сильными межатомными связями d-элемента 6-го периода.
- 4) Ошибка. Рений — металл, а галогены — p-элементы 17-й группы.
- 5) Ошибка. Марганец в 4-м периоде, рений — его тяжелый аналог в 6-м.
- 6) Ошибка. Рений — твердый тугоплавкий металл.
Часто задаваемые вопросы:
Расположен в 6-м периоде, 7-й группе (побочная подгруппа VII группы). Его атомный номер — 75.
Так как рений находится в 6-м периоде, у него 6 энергетических уровней.
Электронная схема распределения по уровням: 2, 8, 18, 32, 13, 2.
Формально рений не входит в группу классических благородных металлов, однако из-за высокой коррозионной стойкости и редкости его часто рассматривают в одном ряду с ними.