Теория:
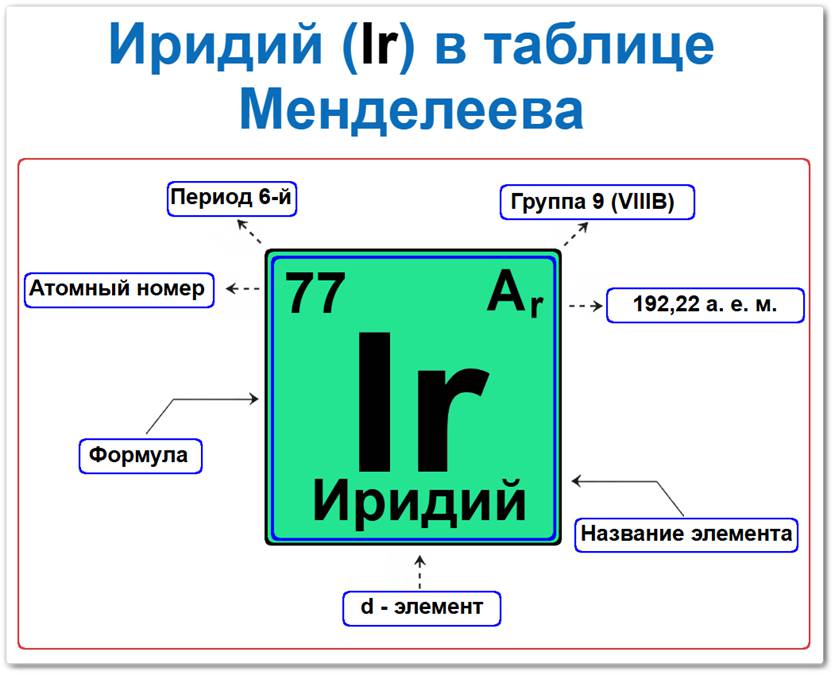
Иридий (Ir) в периодической системе: 6‑й период, 9‑я группа (по устаревшей классификации — VIIIB), атомная масса 192,22 а.е.м.
Занимает положение в 6‑м периоде, что определяет его уникальную природу как одного из самых плотных и коррозионностойких металлов на планете.
Будучи химическим гомологом (аналогом) кобальта и родия, он находится в центре ряда переходных металлов своего периода, входя в группу платиновых металлов.
Высокая прочность связи между атомами в кристаллической решетке обеспечивает иридию невероятную температуру плавления (около 2466°C) и твердость.
А его нахождение в 9‑й группе (ранее — побочная подгруппа VIII группы) задает ключевые параметры:
- Способность проявлять широкий спектр степеней окисления (наиболее устойчивые +3 и +4).
- Высокую каталитическую активность и химическую инертность к кислота.
Структура атома подтверждается его электронной формулой (конфигурацией):
[Xe] 4f14 5d7 6s2
На которой наглядно можно определить его положение как d-блочного элемента, находящегося в процессе заполнения 5d-подуровня.
Иридий в таблице Менделеева можно определить на основании закона периодичности: положение в группе и периоде, а также порядкового номера / атомного номера (Z = 77).
Как определить положение Иридия в Таблице Менделеева
Локация иридия в таблице описывается характеристиками его атомного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (вертикальный ряд, семейство кобальта).
- Период (горизонтальный ряд).
- Электронное семейство (иридий — d‑элемент).
Порядковый номер / атомный номер (Z = 77)
- Служит уникальным кодом элемента в системе.
- В ядре — 77 протонов; в нейтральной оболочке — 77 электронов.
- Электронное строение: [Xe] 4f14 5d7 6s2.
Важно: Частично заполненная 5d-оболочка обуславливает парамагнитные свойства иридия и его способность образовывать многочисленные комплексные соединения.
Название и символ
- Название: «иридий» (от древнегреческого «iris» — радуга, из-за разнообразия цветов его солей).
- Символ: Ir.
- Примечание: Открыт Смитсоном Теннантом в 1803 году вместе с осмием в осадке после растворения природной платины в «царской водке».
Группа (9 / VIII B)
Расположен в 9‑й группе; по классической классификации — побочная подгруппа VIII группы (подгруппа кобальта).
Химический потенциал:
- Валентность иридия: наиболее типичны III и IV, но встречаются от 0 до VI.
- Степень окисления: +3 и +4 являются доминирующими. Иридий — самый стойкий к коррозии металл, не реагирующий с кислотами даже при высоких температурах.
Период (6‑й)
Находится в 6‑м периоде — его электроны распределены по шести энергетическим уровням.
Влияние на свойства:
- Лантаноидное сжатие: Благодаря заполнению 4f-подуровня, атомный радиус иридия почти равен радиусу родия, что объясняет его колоссальную плотность (22,56 г/см³).
- Твердость: Высокая энергия связи d-электронов делает его одним из самых твердых и тугоплавких материалов.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(Ir) ≈ 192,22 а.е.м.
- Определение: средневзвешенное значение массы двух стабильных изотопов: 191Ir и 193Ir.
Все значения для всех элементов можно узнать в таблице атомных масс.
d‑Элемент (электронное семейство)
Застраивающимся является 5d‑подуровень (5d7).
Специфика блока: Будучи d-элементом 6-го периода, иридий входит в «большую тройку» самых тяжелых переходных металлов вместе с осмием и платиной.
Определение энергетических уровней Иридия по Таблице Менделеева
Положение Иридия (Ir) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 6-й период (Количество этажей)
Иридий находится в шестой строке таблицы. Номер периода определяет число электронных слоев.
- Итог: У Иридия 6 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Иридия — 77. Его 77 электронов распределены по уровням следующим образом:
Ir ) 2 ) 8 ) 18 ) 32 ) 15 ) 2
3. 9-я группа (Химический характер)
- d-элемент: Свойства определяются недостроенным 5d-подуровнем.
- Место в блоке: Находится между Осмием (Os) и Платиной (Pt), разделяя с ними исключительную плотность и благородство.
Проверка знаний: Как определить иридий по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Иридий (Ir) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 77. Точное положение Иридия.
- 2) 6-й период, 9-я группа. Указывает на принадлежность к тяжелым платиновым металлам.
- 3) Высокая плотность. Физическое следствие лантаноидного сжатия d-элемента 6-го периода.
- 4) Ошибка. Иридий — d-элемент.
- 5) Ошибка. Иридий в 6-м периоде, он гораздо тяжелее железа.
- 6) Ошибка. Иридий — сверхтвердый и тугоплавкий металл.
Часто задаваемые вопросы:
Иридий расположен в 6-м периоде, 9-й группе (побочная подгруппа VIII группы). Атомный номер — 77.
У иридия 6 энергетических уровней, так как он находится в 6-м периоде.
Электронная схема распределения: 2, 8, 18, 32, 15, 2.
Это связано с его положением в d-блоке 6-го периода: высокая энергия связи электронов и стабильность кристаллической решетки делают его невосприимчивым к воздействию большинства агрессивных сред и кислот.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.