Теория:
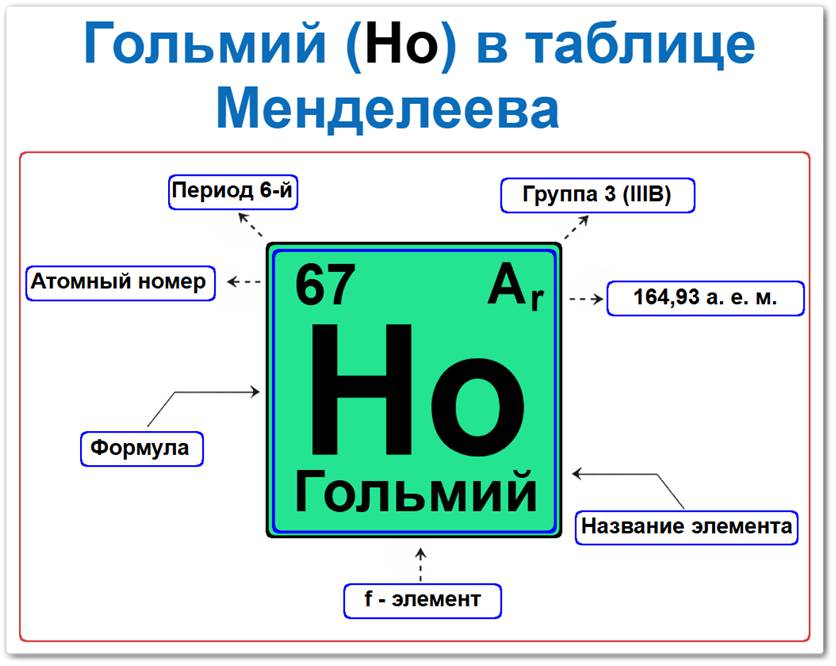
Гольмий (Ho) в периодической системе: 6‑й период, 3‑я группа (по устаревшей классификации — III B), атомная масса 164,93 а.е.м.
Занимает положение в 6‑м периоде, что определяет его принадлежность к семейству лантаноидов — редкоземельных металлов, обладающих самыми высокими магнитными свойствами среди всех элементов.
Будучи химическим аналогом других лантаноидов, он входит в состав большой группы f-элементов, расположенных после Лантана.
Нахождение Гольмия в 3‑й группе (согласно длиннопериодному варианту) и специфическое заполнение f-подуровня обуславливают его ключевые параметры:
Наиболее характерную валентность III.
А также уникальную способность концентрировать магнитный поток (самый высокий магнитный момент), что делает его незаменимым в производстве сверхмощных магнитов.
Структура атома подтверждается его электронной формулой (конфигурацией):
[Xe] 4f11 6s2.
На которой наглядно можно определить его положение как f-блочного элемента, где происходит последовательное заполнение 4f-подуровня.
Гольмий в таблице Менделеева можно определить на основании закона периодичности: положение в ряду лантаноидов период 6, группа III / Лантаноиды, а также по его порядковому номеру (Z = 67).
Как определить положение Гольмия в Таблице Менделеева
Локация гольмия в таблице описывается характеристиками его атомного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (формально 3-я группа, семейство лантаноидов).
- Период (горизонтальный ряд).
- Электронное семейство (гольмий — f‑элемент).
Порядковый номер / атомный номер (Z = 67)
- Служит уникальным кодом элемента в системе.
- В ядре — 67 протонов; в нейтральной оболочке — 67 электронов.
- Электронное строение: [Xe] 4f11 6s2.
Важно: Наличие неспаренных электронов на 4f-оболочке обеспечивает гольмию статус «короля магнетизма». Его используют для создания наконечников полюсов самых сильных магнитов.
Название и символ
- Название: «гольмий» (происходит от латинского Holmia — Стокгольм).
- Символ: Ho.
- Примечание: Открыт Марком Делафонтеном и Жаком-Луи Соре в 1878 году, позже выделен Пером Теодором Клеве из эрбиевой земли.
Группа (3 / III B)
Расположен в 3‑й группе (лантаноиды обычно выносятся в отдельную строку внизу таблицы, но относятся к этой группе).
Химический потенциал:
- Валентность гольмия: типичная валентность III.
- Степень окисления: +3. Оксид гольмия (Ho2O3) проявляет необычный эффект изменения цвета при разном освещении (от желтоватого до розового).
Период (6‑й)
Находится в 6‑м периоде — его электроны распределены по шести энергетическим уровням.
Влияние на свойства:
- Лантаноидное сжатие: Как и соседний эрбий, гольмий имеет компактный атомный радиус, что влияет на плотность и прочность металла.
- Механическая обработка: Гольмий — мягкий и ковкий металл, который легко поддается обработке на воздухе при нормальных условиях.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(Ho) ≈ 164,93 а.е.м.
- Определение: Гольмий является моноизотопным элементом (в природе представлен одним стабильным изотопом Гольмий-165).
Все значения для всех элементов можно узнать в таблице атомных масс.
f‑Элемент (электронное семейство)
Застраивающимся является 4f‑подуровнь (4f11).
Специфика блока: Как f-элемент, гольмий обладает высокой химической активностью в отношении влаги и кислорода, быстро окисляясь при нагревании.
Определение энергетических уровней Гольмия по Таблице Менделеева
Положение Гольмия (Ho) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 6-й период (Количество этажей)
Гольмий находится в шестой строке таблицы. Номер периода определяет число электронных слоев.
- Итог: У Гольмия 6 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Гольмия — 67. Его 67 электронов распределены по уровням следующим образом:
Ho ) 2 ) 8 ) 18 ) 29 ) 8 ) 2
3. 3-я группа (Химический характер)
Гольмий входит в семейство лантаноидов.
- f-элемент: Свойства определяются заполнением 4f-слоя.
- Место в блоке: Относится к «иттриевой» подгруппе тяжелых лантаноидов.
Проверка знаний: Как определить гольмий по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Гольмий (Ho) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 67. Уникальная позиция гольмия.
- 2) 6-й период, лантаноиды. Характеризует редкоземельное семейство.
- 3) Магнитный момент. Ключевая физическая особенность этого металла.
- 4) Ошибка. Гольмий — активный металл, а не газ.
- 5) Ошибка. Гольмий находится в 6-м периоде, он гораздо сложнее и тяжелее углерода.
- 6) Ошибка. Гольмий — f-элемент 3-й группы.
Часто задаваемые вопросы:
Гольмий расположен в 6-м периоде. Он входит в группу лантаноидов (3-я группа). Его порядковый номер — 67.
У гольмия 6 энергетических уровней. Электронная схема распределения: 2, 8, 18, 29, 8, 2.
Гольмий является f-элементом. Его уникальные магнитные свойства обусловлены строением внутреннего 4f-подуровня.