Теория:
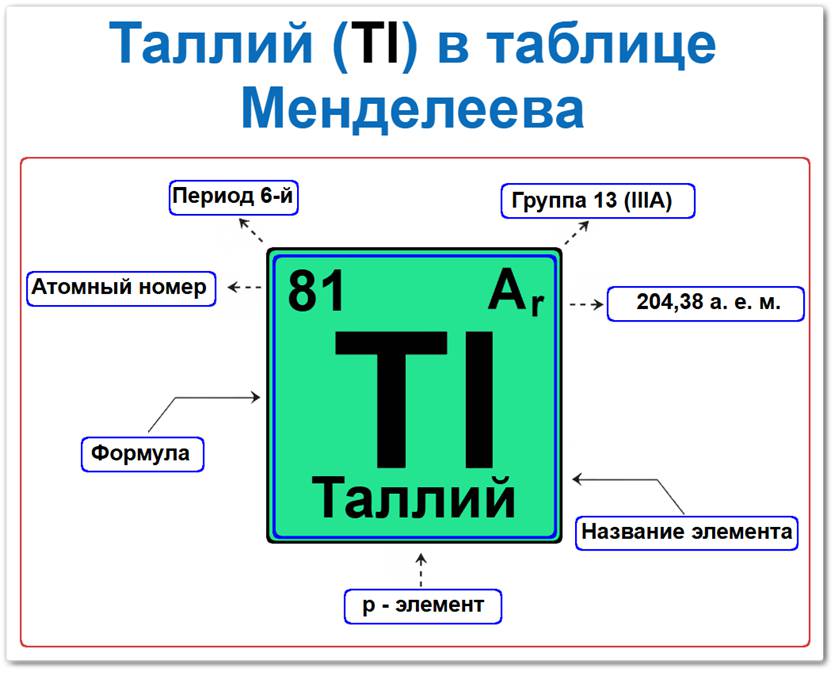
Таллий (Tl) в периодической системе: 6‑й период, 13‑я группа (по устаревшей классификации — IIIA), атомная масса 204,38 а.е.м.
Занимает положение в 6‑м периоде, что определяет его принадлежность к ряду тяжелых металлов главной подгруппы III группы (13-я группа в современной классификации).
Будучи химическим гомологом (аналогом) индия и алюминия, он проявляет специфические свойства «мягкого» металла.
Из-за эффекта инертной электронной пары его поведение в растворах часто напоминает калий (в степени окисления +1) или серебро, что делает его химию уникальной среди соседей по периоду.
А его нахождение в 13‑й группе задает ключевые параметры: возможные степени окисления +1 и +3.
При этом состояние +1 для таллия является наиболее стабильным, что отличает его от более легких элементов той же группы.
Структура атома подтверждается его электронной формулой (конфигурацией):
[Xe] 4f14 5d10 6s2 6p1.
На которой наглядно можно определить его положение как представителя p-блока, находящегося за ртутью и перед свинцом.
Таллий в таблице Менделеева можно определить на основании закона периодичности: положение в группе и периоде, а также порядкового номера / атомный номер (Z = 81).
Как определить положение Таллия в Таблице Менделеева
Локация таллия в таблице описывается характеристиками его тяжелого ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (вертикальный ряд 13 / III A).
- Период (горизонтальный ряд).
- Электронное семейство (таллий — p‑элемент).
Порядковый номер / атомный номер (Z = 81)
- Служит уникальным кодом элемента в ряду стабильных (и долгоживущих) тяжелых металлов.
- В ядре — 81 протон; в нейтральной оболочке — 81 электрон.
- Электронное строение: [Xe] 4f14 5d10 6s2 6p1.
Важно: Наличие одного электрона на 6p-подуровне при инертной паре 6s2 определяет его склонность к образованию чрезвычайно стабильных соединений одновалентного таллия.
Название и символ
- Название: «таллий» (от греч. thallos — молодая зеленая ветвь, из-за ярко-зеленой линии в спектре).
- Символ: Tl.
- Примечание: Элемент был открыт Уильямом Круксом в 1861 году спектроскопическим методом в шламах свинцовых камер.
Группа (13 / III A)
Расположен в 13‑й группе (главная подгруппа III группы), возглавляемой бором.
Химический потенциал:
- Валентность таллия: проявляет валентности I и III.
- Степень окисления: наиболее устойчива +1. Гидроксид таллия (TlOH) является сильным основанием, подобно щелочам, что уникально для металлов этой группы.
Период (6‑й)
Находится в 6‑м периоде — его электроны распределены по шести энергетическим уровням.
Влияние на свойства:
- Металлический блеск и мягкость: Таллий настолько мязок, что его можно резать ножом, подобно свинцу.
- Высокая токсичность: Из-за сходства ионов Tl+ с ионами калия K+, таллий легко проникает в биологические системы, блокируя жизненно важные процессы.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(Tl) = 204.38 а.е.м.
- Определение: средневзвешенная масса природных изотопов (основные 203Tl и 205Tl).
- Плотность: Таллий — очень тяжелый металл, его плотность составляет 11.85 г/см³, что чуть больше плотности свинца.
Все значения для всех элементов можно узнать в таблице атомных масс.
p‑Элемент (электронное семейство)
Застраивающимся является внешний 6p‑подуровнь (6p1).
Специфика блока: Как типичный p-металл конца периода, таллий обладает низкой температурой плавления (304°C) и проявляет амфотерные черты в высших степенях окисления, хотя в целом преобладают металлические свойства.
Определение энергетических уровней Таллия по Таблице Менделеева
Положение Таллия (Tl) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 6-й период (Количество этажей)
Таллий находится в шестой строке таблицы. Номер периода совпадает с общим числом электронных слоев.
- Итог: У Таллия 6 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Таллия — 81. Его 81 электрон распределен по уровням следующим образом:
Tl ) 2 ) 8 ) 18 ) 32 ) 18 ) 3
Для сравнения: У соседа слева, Ртути (80), на внешнем уровне 2 электрона, а у Таллия (81) появляется первый электрон на p-подуровне (всего 3 на внешнем слое).
3. 13-я группа (Химический характер)
Таллий входит в главную подгруппу III группы.
- p-элемент: Его валентные свойства определяются конфигурацией 6s26p1.
- Место в блоке: Он является самым тяжелым стабильным элементом своей подгруппы, проявляя металлические свойства гораздо ярче, чем бор или алюминий.
Проверка знаний: Как определить таллий по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Таллий (Tl) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 81. Фундаментальный номер таллия в системе.
- 2) 13-я группа, 6-й период. Точные координаты элемента.
- 3) p-элемент. Это определяет его положение в правой части таблицы (p-блок).
- 4) Ошибка. Таллий крайне ядовит («яд отравителей») и никогда не используется в медицине таким образом.
- 5) Ошибка. Алюминий находится в 3-м периоде, таллий — в 6-м.
- 6) Ошибка. Таллий — типичный тяжелый металл, а не газ.
Часто задаваемые вопросы:
Он расположен в 6-м периоде, 13-й группе (главная подгруппа III группы). Порядковый номер — 81.
Так как элемент находится в 6-м периоде, у него 6 энергетических уровней.
Распределение электронов: 2, 8, 18, 32, 18, 3.
Относительная атомная масса таллия составляет 204.38 а.е.м.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.