Теория:
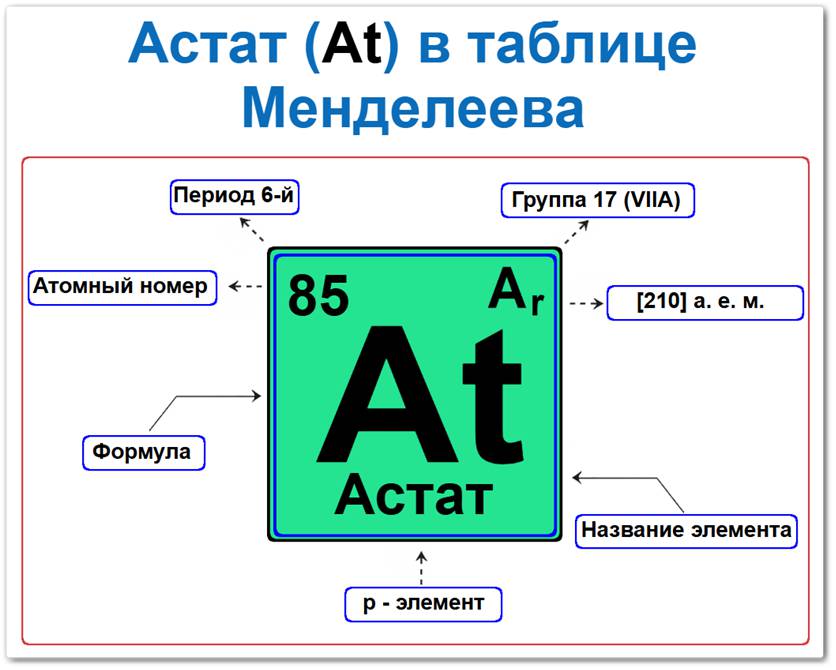
Астат (At) в периодической системе: 6‑й период, 17‑я группа (по устаревшей классификации — VIIA), атомная масса [210] а.е.м.
Занимает положение в 6‑м периоде, что определяет его принадлежность к группе галогенов, но при этом наделяет его заметными металлическими свойствами из-за близости к границе раздела металлов и неметаллов.
Будучи химическим гомологом (аналогом) йода, он является самым тяжелым представителем 17‑й группы.
Его поведение продиктовано заполнением 6p-подуровня, что делает его менее электроотрицательным, чем остальные галогены.
А его нахождение в 17‑й группе (главная подгруппа VII группы) задает ключевые параметры:
- Валентность I, III, V и VII.
- А также склонность к образованию соединений, где он может проявлять свойства, близкие к металлоидам.
Структура атома подтверждается его электронной формулой (конфигурацией):
[Xe] 4f14 5d10 6s2 6p5.
На которой наглядно можно определить его положение как представителя p-блока, завершающего ряд галогенов перед благородным газом радоном.
Астат в таблице Менделеева можно определить на основании закона периодичности: положение в группе и периоде, а также порядкового номера / атомный номер (Z = 85).
Как определить положение Астата в Таблице Менделеева
Локация астата в таблице описывается характеристиками его крайне нестабильного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (вертикальный ряд галогенов).
- Период (горизонтальный ряд/строка).
- Электронное семейство (астат — p‑элемент).
Порядковый номер / атомный номер (Z = 85)
- Служит уникальным кодом элемента в ряду естественных радиоактивных рядов.
- В ядре — 85 протонов; в нейтральной оболочке — 85 электронов.
- Электронное строение: [Xe] 4f14 5d10 6s2 6p5.
Важно: Наличие 5 электронов на 6p-подуровне роднит его с йодом и бромом, но заполненные 4f и 5d подоболочки усиливают его «тяжелый» металлический характер.
Название и символ
- Название: «астат» (от греческого «астатос» — неустойчивый).
- Символ: At.
- Примечание: Это самый редкий элемент в земной коре. В любой момент времени на всей планете находится не более 30 граммов астата.
Группа (17 / VII A)
Расположен в 17‑й группе; по классической классификации — главная подгруппа VII группы (группа галогенов).
Химический потенциал:
- Валентность астата: наиболее характерна I, но проявляет и высшие валентности.
- Степень окисления: от -1 (как неметалл) до +7 (в сильных окислителях). Из-за низкой электроотрицательности может существовать в виде катиона At+.
Период (6‑й)
Находится в 6‑м периоде — его электроны распределены по шести энергетическим уровням.
Влияние на свойства:
- Металлические черты: В отличие от йода, астат может осаждаться на катоде из растворов, что типично для металлов.
- Радиоактивность: У астата нет стабильных изотопов. Весь астат в природе является промежуточным продуктом распада урана и тория.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(At) ≈ [210] а.е.м. (для изотопа 210At).
- Определение: средняя масса самого долгоживущего нуклида.
- Стабильность: Астат-210 имеет период полураспада всего 8,1 часа. Это делает его изучение чрезвычайно сложным — он буквально исчезает в руках экспериментатора.
Все значения для всех элементов можно узнать в таблице атомных масс.
p‑Элемент (электронное семейство)
Застраивающимся является 6p‑подуровнь (6p5).
Специфика блока: Относится к семейству p-элементов. Находится в самом низу колонки галогенов, демонстрируя максимальный атомный радиус в своей группе.
Определение энергетических уровней Астата по Таблице Менделеева
Положение Астата (At) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 6-й период (Количество этажей)
Астат находится в шестой строке таблицы. Номер периода указывает на число электронных слоев.
- Итог: У Астата 6 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Астата — 85. Его 85 электронов распределены по уровням следующим образом:
At ) 2 ) 8 ) 18 ) 32 ) 18 ) 7
Для сравнения: У соседа сверху, Йода (53), на пятом уровне 7 электронов (внешний слой), а у Астата (85) — 7 электронов на шестом уровне. Это сходство определяет их общие химические свойства.
3. 17-я группа (Химический характер)
Астат завершает ряд классических галогенов.
-
- p-элемент: Его активность определяется пятью электронами на внешнем p-подуровне.
- Место в блоке: Он является самым «металлическим» неметаллом в своей группе, занимая ячейку под йодом.
Проверка знаний: Как определить астат по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Астат (At) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 85. Это «имя» астата на языке протонов.
- 2) 6-й период, 17-я группа. Точные координаты элемента.
- 3) Тяжелый галоген. Он закрывает подгруппу галогенов, обладая наибольшей массой в ней.
- 4) Ошибка. Астат радиоактивен и слишком редок для промышленного использования.
- 5) Ошибка. Астат — редчайший элемент Земли.
- 6) Ошибка. Астат не имеет стабильных изотопов, он постоянно распадается.
Часто задаваемые вопросы:
Расположен в 6-м периоде, 17-й группе (VIIA подгруппа). Он находится прямо под Йодом (I).
Так как он находится в 6-м периоде, у него 6 энергетических уровней. Распределение электронов: 2, 8, 18, 32, 18, 7
Относительная атомная масса составляет примерно [210] а.е.м. для наиболее долгоживущего изотопа 210At.