Все окружающие нас вещества состоят из молекул, которые объясняют все его физические и химические свойства.
Молекулы состоят из атомов, в природе на данный момент встречается известных нам сто восемнадцать химических элементов.
Все они учтены и расположены в таблице химических элементов, первым из них считается водород Н, последним Оганесон Og.
Строение атома и ядра: протоны, нейтроны, атомный вес, изотопы
Атомное ядро
Строение и свойства ядра атома изучаются физикой.
Атом состоит из:
1. Ядра.
2. Электронов.
Ядро представляет собой самую тяжелую часть атома. Атомная масса — это фактически масса ядра. Масса электронов настолько мала, что мы ею пренебрегаем.
Ядро состоит из двух видов элементарных частиц — протонов и нейтронов. Протон — частица, имеющая вес примерной 1 у.е. (углеродную единицу) и заряд +1.
Условное обозначение протона +11р. Нейтрон — частица, не имеющая заряда; вес ее равен 1 у. е. Условное обозначение нейтрона 10n.
Следовательно, протон и нейтрон имеют примерно одинаковый вес, но различаются по заряду. Заряд ядра атома определяется количеством протонов в ядре, а вес ядра атома равен сумме весов протонов и нейтронов.
Чем больше заряд ядра атома, тем больше атомный вес. Периодическая зависимость свойств элементов от зарядов ядер атомов обнаружила себя при рассмотрении атомных весов элементов.
Зная атомный вес элемента, а также заряд ядра его атома, нетрудно подсчитать число нейтронов в ядре.
Например, если заряд 4 ядра атома углерода равен +6, то это значит, что в ядре атома углерода имеется 6 протонов. А поскольку атомный вес углерода равен 12, то в его ядре 12 — 6 = 6 нейтронов.
➡️1. Рассчитайте число нейтронов в ядрах атомов фосфора, серебра, алюминия, мышьяка. (См. Ответ)
Изотопы
Протоны и нейтроны связаны между собой внутриядерными силами взаимодействия. Эти силы чрезвычайно велики и действуют лишь на очень малых расстояниях.
Характер внутриядерных сил выяснен не до конца. Однако ясно, что он иной, чем у кулоновских сил электростатического притяжения или отталкивания.
Ядра атомов одного и того же элемента не всегда одинаковы. Количество протонов у них одинаково, но количество нейтронов может быть различно.
В этом случае атомы одного и того же элемента имеют один и тот же заряд ядра, но разный вес.
Разновидности одного и того же элемента, имеющие одинаковый заряд ядра, но разный атомный вес, называются изотопами (от греческих слов «изос» — одинаковый, «топос» — место), так как занимают одно и то же место в периодической системе элементов.
Примеры изотопов
Ярким примером этого явления могут служить изотопы водорода, которых известно три:
1. Протий.
2. Дейтерий.
3. Тритий.
Протий имеет ядро, представляющее собой один протон. Вокруг ядра вращается один электрон. Атомный вес протия равен 1 у. е.
Схему строения протия можно записать следующим образом:
Дейтерий имеет ядро, состоящее из одного протона и одного нейтрона. Следовательно, его атомный вес равен 2 у. е.
Вокруг этого ядра, так как его заряд продолжает оставаться равным +1, вращается один электрон. Схема строения такого изотопа изображается следующим образом:
Тритий имеет ядро, состоящее из одного протона и двух нейтронов. Вследствие этого заряд ядра продолжает оставаться равным +1, а вокруг ядра вращается также один электрон. Атомный вес равен 3 у. е.
Схема строения этого изотопа изображается так:
Дейтерий и тритий называются тяжелыми изотопами водорода. Если атом дейтерия или трития входит в состав молекулы воды, то вес такой молекулы увеличивается и такая вода называется тяжелой водой.
➡️2. Объясните, почему изотопы с одним и тем же зарядом ядра имеют разный атомный вес. (См. Ответ)
Изотопы урана
Есть изотопы и у такого тяжелого элемента, как уран. Он имеет изотопы с атомными весами 238, 239, 235.
Ядра 235U весьма неустойчивы: например, при воздействии нейтронов, вылетающих из ядер самого урана, они могут распадаться с выделением большого количества энергии.
Изотопы 238U также могут распадаться под действием нейтронов, но для этого нужны очень быстрые нейтроны, поэтому разбить ядра 238U гораздо труднее.
Объяснение почему атомные веса дробные
При рассмотрении атомных элементов можно заметить, что почти у всех элементов атомные веса дробные.
Это объясняется тем, что каждый элемент встречается в природе в виде разных изотопов и в разном количестве.
Так как при подсчетах учитывается количество того или иного изотопа в земной коре, то получается дробное число.
После изучения явления изотопии стали понятными некоторые «нарушения» последовательного возрастания атомных весов элементов в периодической системе.
Например, уменьшение атомного веса от аргона (№ 18) к калию (№ 19) объясняется наличием у калия значительного процента легких изотопов, а у аргона — тяжелых.
При подсчете средних массовых чисел получается, что у калия оно меньше, чем у аргона. Тем не менее величина зарядов ядер этих элементов убедительно подтверждает правильность их расположения в таблице.
То же самое можно сказать о последовательности кобальт (№ 27) — никель (№ 28), а также теллур (№ 52) — йод (№ 53).
➡️ 3. Почему в таблице Д. И. Менделеева атомные веса даны дробными, в то время как атом всегда состоит из целого числа элементарных частиц? (См. Ответ)
4. Чем объяснить, что в отдельных случаях в периодической системе происходит нарушение последовательности возрастания атомных весов? Приведите примеры таких нарушений.
5. Число нейтронов в ядре 12, атомный вес 24. Какой это элемент?
Движение электронов
Вокруг ядра атома любого элемента движутся электроны. При этом в нейтральном атоме число электронов равно числу протонов в ядре.
Электрон движется с большой скоростью в пространстве около ядра. В некоторых точках пространства он бывает реже, а в некоторых очень часто.
Эти точки могут быть и немного ближе к ядру и немного дальше от него. Совокупность точек в пространстве около ядра, где наиболее часто бывает электрон, называют орбиталью. Орбиталь объемная (рис. 1).
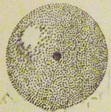
Вполне понятно, что четко обрисовать границы орбитали нельзя, они будут расплывчатыми.
Если бы мы могли взглянуть на электронную орбиталь, то не увидели бы отдельных точек, в которые попадает электрон, так как он движется с огромной скоростью.
Для нас все эти точки слились бы в расплывчатое электронное облако. В тех точках, куда электрон попадает наиболее часто, образуется так называемое место наибольшей электронной плотности.
Двигаясь вокруг ядра, электрон одновременно вращается вокруг своей оси. Это называется спиновым вращением, или просто спином.
Если два электрона имеют одинаковые направления спинового вращения, тогда говорят, что это электроны с параллельными спинами.
Если у двух электронов противоположные направления спинового вращения, то говорят, что это электроны с антипараллельными спинами.
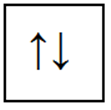
На одной орбитали могут находиться только электроны с антипараллельными спинами.
Довольно часто при изучении атомных структур приходится пользоваться условным схематическим обозначением орбитали , где квадратик
обозначает орбиталь, а стрелки — электроны с антипараллельными спинами.
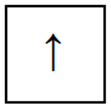
Одноэлектронная орбиталь изображается с одной стрелкой:
➡️6. Что такое спиновое вращение электрона? Какие спины называются параллельными, какие антипараллельными и какое условное обозначение для них существует?(См. Ответ)
Орбитали
Расположение орбитали относительно ядра, ее форма и размеры определяются запасом энергии, которым обладает находящийся на ней электрон.
Электронная орбиталь может иметь форму шара (сферическую) (см. рис. 1). Понятно, что на каком-то определенном расстоянии от ядра может быть только одна сферическая орбиталь (условное обозначение s-орбиталь).
На ней могут двигаться только два электронах антипараллельными спинами.
Эти электроны называют s-электронами.
Помимо шаровидной, орбиталь может иметь форму гантели (рис. 2), а иногда и более сложную форму. Гантелевидные орбитали обычно взаимно перпендикулярны, подобно осям координат х, у и z (рис. 3).
Эти орбитали называются р-орбиталями.
На каждой из них могут находиться 2 электрона с антипараллельными спинами.

Эти электроны называются электронами, таким образом, на трех р-орбиталях может находиться 6 электронов.
Если электроны имеют орбитали разной формы, но с близким по величине запасом энергии, говорят, что такие электроны находятся на одном и том же энергетическом уровне.
Электроны одного и того же энергетического уровня образуют вокруг ядра электронный слой.
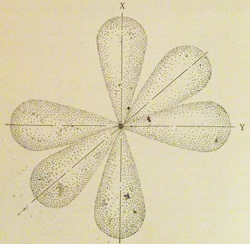
Внутри электронного слоя в зависимости от формы орбиталей различают электронные оболочки.
Так, электроны s-орбитали образуют s-оболочку, а электроны р-орбиталей — р-оболочку.
➡️7. Какую форму имеет s-оболочка? Сколько электронов может находиться на s-оболочке?(См. Ответ)
8. Можно ли сказать, что s-оболочка и s-орбиталь — это одно и то же?
9. Что такое р-оболочка? Сколько орбиталей может включать р-оболочка? Какой они формы? Каково максимальное число электронов, образующих р-оболочку?
d и f орбитали
Помимо s — и р — орбиталей, существуют еще d— и f — орбитали. Они более сложны по форме и энергетически менее выгодны.
Обычно электроны занимают эти орбитали лишь тогда, когда s и р — орбитали уже заполнены.
Для d — оболочки возможно пять положений орбиталей.
Поэтому на d — оболочке может находиться до 10 электронов, а на f — оболочке до 14 электронов.
➡️ 10. Составьте рассказ о движении электрона по следующему плану:
а) Формы электронных орбиталей. Возможное число электронов на орбитали;
б) Электронные оболочки, их буквенные обозначения;
в) Максимальное число электронов, содержащееся на каждой оболочке;
г) Движение электрона по орбитали, электронный спин.(См. Ответ)
Характеристика орбиталей
Датским ученым Нильсом Бором в 1913 г. было установлено следующее. Каждая орбиталь (Бор называл их орбитами) имеет строго определенные размеры и потому называется стационарной или устойчивой.
Двигаясь по такой орбитали, электрон не выделяет и не поглощает энергии, а полностью сохраняет ее запас.
Движение по орбитали когда электрон не выделяет, не поглощает энергию называется нормальным.
Если электрону сообщить дополнительно энергию извне, то он «возбуждается» и ядро не может больше удерживать его вблизи себя.
Тогда электрон отодвигается на более удаленный от ядра (более высокий) энергетический уровень, соответствующий большему запасу энергии.
Перескок электрона с более высокого уровня наиболее низкий сопровождается излучением некоторого количества энергии.
Чем дальше от ядра, тем большим запасом энергии обладает электрон, тем слабее удерживается он ядром, а нередко может вовсе оторваться от своего атома,
Наиболее подвижен внешний энергетический уровень. Оcoбенно легко от него отрываются электроны; если их немного — один, два, три например в атомах металлов.
Чем ближе к ядру тем меньше запас энергии электрона, тем прочнее удерживается оно около ядра.
➡️11. Почему электронные орбитали были названы Бором стационарными?(См. Ответ)
12. Как меняется запас энергии электрона при перескоке:
а) С более удаленного на более близкий к ядру энергетический уровень;
б) С более близкого на более удаленный?
Энергетические уровни в атоме
Энергетических уровней в атоме известно семь, как и периодов в периодической таблице элементов.
Электроны, обладающие одинаковым запасом энергии, находятся на одном и том же энергетическом уровне. Электроны одного и того же энергического уровня образуют электронный слой.
Электронных слоев, так же как энергетических уровней, известно семь, они имеют буквенные обозначения. Счет их ведется от ядра.
Первый слой, ближайший к ядру, обозначается буквой К, второй — L, третий — М, четвертый — N, пятый — О, шестой — Р, седьмой — Q.
Главное квантовое число
Основной характеристикой электронного слоя является главное квантовое число n. Оно определяет положение слоя относительно ядра, запас энергии электронов данного слоя и позволяет рассчитать максимальное число электронов, которое может расположиться на данном электронном слое.
Для каждого электронного слоя характерно свое значение главного квантового числа. Для слоя Кn = 1, для слоя Ln = 2, для Мn = 3 и т. д.
Другими словами, главное квантовое число совпадает с номером электронного слоя. Максимальное число электронов в электронном слое рассчитывается по формуле x = 2n2, где n — главное квантовое число.
Например, на первом слое К, где n = 1, может размещаться не более двух электронов, на втором слое L, где n = 2, — не более 8 электронов, на третьем M, где n = 3, — не более 18, на четвертом N, где n = 4, — не более. 32 и т. д.
На внешнем электронном слое, каким бы по счету он ни был, может располагаться не более 8 электронов (октет). Такой слой является завершенным.
➡️13. Какие буквенные обозначения имеют электронные слои?
14. Для чего необходимо знать значение главного квантового числа?
15. По какой формуле можно рассчитать максимальное число электронов в электронном слое?(См. Ответ)
16. Какое максимальное число электронов может располагаться на внешнем электронном слое?\
Три квантовых числа
Помимо главного, существует еще три квантовых числа, характеризующих состояние электронных орбиталей.
Например, побочное квантовое число l определяет форму орбитали, магнитное квантовое число m определяет положение орбитали в пространстве, а спиновое квантовое число ms определяет направление спинового вращения электрона.
Все эти квантовые числа зависят от главного квантового числа. В 1925 г. немецким ученым Паули было установлено, что в атоме не может быть двух электронов, у которых все четыре квантовых числа одинаковы.
Это положение получило название принципа Паули (запрета Паули). В соответствии с этим принципом электроны должны обязательно отличаться хотя бы одним квантовым числом.
Именно поэтому на одной орбитали не может размещаться более двух электронов. Они отличаются друг от друга только спиновым квантовым числом ms.
Остальные квантовые числа у них совпадают. Электронные пары, о которых говорилось выше, могут возникнуть в том случае, если два электрона различаются между собой только значением спинового квантового числа.
Если главное квантовое число определяет энергетический уровень или электронный слой, на котором расположены электроны, то остальные квантовые числа определяют расположение электронов внутри слоя по подслоям, или, как их еще называют, оболочкам.
Замечено также, что если электроны располагаются на одной и той же электронной оболочке, то для них энергетически выгоднее занять возможно большее число орбиталей.
➡️ 17. Что характеризуют квантовые числа l, т и ms?(См. Ответ)
18. В чем заключается принцип Паули? 19. Какая из электронных оболочек внутри электронного слоя наиболее энергетически выгодна?
Вещества в химии принято разделять на индивидуальные вещества (простые и сложные), организованные в атомы, молекулы, ионы и радикалы, и их смеси.
Простое вещество образовано атомами одного химического элемента и является формой его существования в свободном состоянии (элементарная сера, железо, озон, алмаз, азот, …).
Вещества состоящие из одинаковых молекул, собранных из одного набора атомов, получают название веществ молекулярной структуры.
Эти вещества обладают общими свойствами, такими как слабые связи между молекулами, которые могут разорваться при незначительном повышении температуры.
В результате такого разрыва происходит переход вещества из твердого состояния в жидкое состояние, а затем — в газообразную фазу.
К веществам немолекулярного строения относятся вещества, состоящие либо из одиночных атомов, либо из ионных соединений.

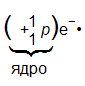

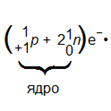
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.