Побочная подгруппа V группы
Ванадий V, ниобий Nb, тантал Та — ( устаревшая классификация: элементы побочной подгруппы V группы) — принадлежат к числу d-элементов, так как у них в процессе завершения d-оболочка пред внешнего слоя.
В новой классификации это элементы подгруппы ванадия, химические элементы 5-й группы.
Распределение электронов по энергетическим уровням атомов этих элементов приведено в табл.1, физические свойства тантала и ванадия — в табл. 2.
Эти элементы имеют бивалентных электронов, расположенных на внешнем и пред внешнем слое.
Структура внешнего электронного слоя этих элементов говорит о том, что в окислительно-восстановительных реакциях они проявляют восстановительные свойства.
Тем не менее для них возможна высшая степень окисления +5.
Таблица распределение электронов по энергетическим уровням атомов
| Элемент | Заряд ядра | Число электронов на энергетических уровнях | ||||||
| K | L | M | N | O | P | Q | ||
| Ванадий V | + 23 | 2 | 8 | 11 | 2 | |||
| Ниобий Nb | + 41 | 2 | 8 | 18 | 12 | 1 | ||
| Тантал Та | + 73 | 2 | 8 | 18 | 32 | 11 | 2 | |
Таблица 2 физические свойства ванадия и тантала.
| Элемент | Порядковый номер | Атомный вес | Температура плавления, °С | Температура кипения, °С | Плотность, г/смЗ |
| Ванадий V | 23 | 50,9 | 1715 | 3400 | 6,0 |
| Тантал Та | 73 | 180,9 | 3000 | 5300 | 16,6 |
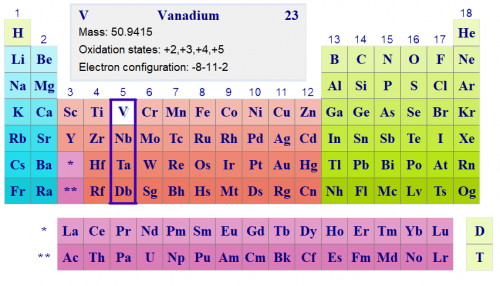
Ванадий V
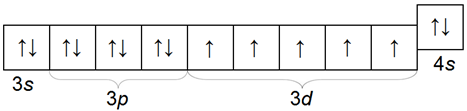
Электронная конфигурация ванадия внешнего и пред внешнего слоя атома 3s23p63d34s2.
Ванадий — вещество химически стойкое. Защитная окисная пленка делает металл устойчивым к действию воды, сильных кислородных кислот и растворов щелочей.
Однако при нагревании ванадий активно реагирует с кислородом, образуя высший окисел — окись ванадия (V), или ванадиевый ангидрид:
4V + 5O2 = 2V2O5
Реагирует ванадий с галогенами и серой, образуя соответствующие соли, с азотом, образуя нитриды, с фосфором (фосфиды), с углеродом (карбиды), а также с кремнием и другими простыми веществами.
➡️ 43. Напишите уравнения реакций ванадия с кислородом, серой, галогенами. (См. Ответ)
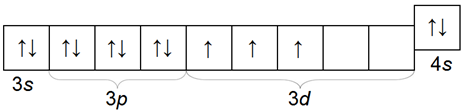
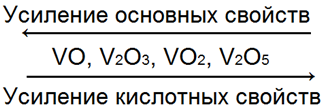
Соединения ванадия — это разного состава окислы с различной степенью окисления VO(2+), V2O3(3+), VO2(4+), V2O5(4+).
Чем меньше степень окисления, тем ярче выражен основной характер окисла:
Если VO — основной окисел, a V2O3 и VO2 — окислы амфотерные, то V2O5 — типичный кислотный окисел, которому соответствуют такие же три формы ванадиевых кислот, как и у фосфора:
- HVO3 — метаванадиевая.
- H3VO4 — ортованадиевая.
- H4V2O7— пированадиевая.
Соли этих кислот называются ванадатами. Соединения являются обычно наиболее устойчивыми.
➡️ 44. Зная, что V2O5 — типичный кислотный окисел, напишите уравнения реакций между ванадиевым ангидридом и:
а) окисью кальция,
б) гидроокисью натрия,
в) гидроокисью бария.
Дайте названия полученным соединениям.
45. Зная, что VO — основной окисел, напишите уравнения реакций между окисью ванадия и: а) серной кислотой, б) соляной кислотой. (См. Ответ)
В природе ванадий встречается довольно часто, но крупные его месторождения неизвестны, он рассеян в земной коре.
Применяется ванадий в сплавах для легирования сталей, используемых в авиационной и ракетной технике.
Соединения ванадия, например V2O5, используются в качестве катализатора при контактном способе получения серной кислоты.
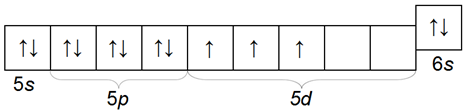
Тантал Та
Тантал — наиболее тяжелый элемент этой подгруппы. Электронная конфигурация тантала внешнего и пред внешнего слоев 5s25p65d36s2.
Тантал среди всех элементов данной подгруппы наиболее устойчив к коррозии. Он не окисляется даже царской водкой.
Тантал обладает очень интересным свойством — не отторгается организмом, легко обрастает соединительной тканью и применяется для изготовления протезов костей.
Устойчивость к окислению позволяет применить тантал для изготовления деталей химической аппаратуры, зубоврачебных и хирургических инструментов.
Карбиды тантала (соединения с углеродом) используются для изготовления режущих инструментов.
Тантал очень пластичен.
➡️ 46. Укажите наиболее важные свойства тантала и их применение. (См. Ответ)
Хром Сr (побочная подгруппа VI группы)
Из элементов побочной подгруппы VI группы мы остановимся на хроме Сr. Атомный вес его 51,99, заряд ядра +24.
Распределение электронов по энергетическим уровням атома хрома: 2, 8, 13, 1.
Электронная конфигурация хрома внешнего и пред внешнего слоев атома 4s24p64d55s1.
Плотность хрома 6,92, температура плавления 1615°, температура кипения 2200°.
Хром получают из руды — хромистого железняка FeO • Cr2O3, в основном в виде сплава, который называется феррохром (содержит от 27 до 60% хрома).
Если требуется получить чистый хром, применяют метод алюминотермии:
Сr2O3 + 2Аl = Аl2O3 + 2Сr.
Хром в чистом виде — блестящий белый металл, наиболее твердый среди металлов (по твердости близок к алмазу), относительно устойчив к коррозии и эти свойства передает сплавам.
Хром используют не только в качестве добавок к сплавам, но и для покрытия (хромирования) металлических изделий с целью придания им большей устойчивости к коррозии и износу.
В ряду напряжений хром стоит левее водорода и может, хотя и медленно, вытеснять его из соляной кислоты и разбавленной серной.
В результате образуются соединения Сr+3.
Для хрома возможны соединения с различными степенями окисления этого элемента:
- Сr+2.
- Сr+3.
- Сr+6.
Наибольший интерес представляют соединения Сr+3 и Сr+6.
Представителями соединений Сr+3 являются окись хрома (III) Сr2O3, гидроокись хрома Сr(ОН)3 и соли Cr2(SO4)3, CrCl3 и т. д.
Довольно часто в лаборатории поступают реактивы, которые носят название квасцов.
Они представляют собой двойные соли, например KCr(SO4)6 — хромово-калиевые квасцы, NH4Cr(SO4)2 — хромово-аммиачные квасцы.
Обычно они кристаллизуются с 12 молекулами кристаллизационной воды.
Окись хрома (III) Cr2O3 — твердое вещество зеленого цвета.
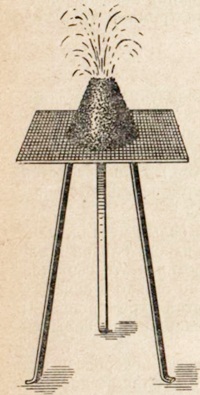
Ее очень легко получить в лаборатории при нагревании бихромата аммония (NH4)2Cr2О7, который разлагается по уравнению:
(NH4)2Cr2O7 = N2 + 4Н2O + Сr2O3
Реакция начинается при нагревании и идет с выделением тепла и сильным увеличением объема продуктов реакции (рис. ниже).
Окись хрома (III) применяется при изготовлении цветных стекол.
Рис. Разложение бихромата аммония
Гидроокись хрома (III) Сr(ОН)3 — серо-зеленый студенистый осадок, который получается при действии щелочей на соли хрома (III):
Cr2(SO4)3 + 6NaOH = 2Cr(OH)3 + 3Na2SO4
2Cr3+ + 3SO24— + 6Na+ + 6OH— = 2Cr(OH)3 + 6Na+ + 3SO24—
Cr3+ + 3ОН— = Cr(OH)3
Гидроокись хрома — вещество амфотерное, легко растворяющееся как в кислотах, так и в щелочах:
Cr(OH)3 + 3НСl = СrСl3 + 3Н2O
Сr(ОН)3 + 3Н+ = Сr3+ + 3Н2O
Cr(OH)3 + NaOH = NaCrO2 + 2Н2O
Сr(ОН)3 + ОН— = СrО—2 + 2Н2O
В этом окись и гидроокись хрома (III) весьма сходные аналогичными соединениями алюминия.
Соли Сr+3 окрашены обычно в фиолетовый цвет.
Они применяются в кожевенной промышленности для дубления кож, при крашении тканей в качестве протравы, в цветной фотографии, в типографском деле.
Соли, содержащие анион СrО—2, носят название хромитов.
В окислительно-восстановительных реакциях соединения, содержащие Сr+3, играют роль восстановителя.
Соединения хрома в степени окисления Сr+6 — хромовые кислоты и их соли. Хромовая кислота Н2СrO4 образует соли, называемые хроматами:
- Na2CrO4 — хромат натрия,
- К2СrO4 — хромат калия и т. д.
Двухромовая кислота Н2Сr2O7 образует бихроматы:
- К2Сr2O7 — бихромат калия (так называемый хромпик),
- Na2Cr2O7 — бихромат натрия и т.д.
Хроматы имеют желтую окраску, а бихроматы — оранжевую.
Такие соли в окислительно-восстановительных процессах ведут себя как сильные окислители.
Это свойство их используется, например, для приготовления так называемой хромовой смеси для мытья стеклянной химической посуды (насыщенный раствор хромпика смешивается с концентрированной серной кислотой).
Постепенно окисляя загрязнения на стенках посуды, хромовая смесь восстанавливается, меняя со временем свою окраску.
После изменения окраски на зеленую в результате образования хромитов смесь надо менять.
Окислительные свойства хроматов используются также для пассивирования поверхности металлов. Некоторые хроматы применяются при изготовлении минеральных красок.
➡️ 47. Напишите уравнения реакций металлического хрома с разбавленной серной и соляной кислотой. (См. Ответ)
48. Предложите способ получения хромово-калиевых квасцов.
49. Приведите уравнения реакций, подтверждающих амфотерный характер окиси и гидроокиси хрома (III) в молекулярной, полной ионной и сокращенной ионной формах.
50. В чем главная особенность химических свойств соединений Сr+3?
51. Перечислите основные области применения соединений хрома.
52. Приведите примеры окислительного действия соединений Сr+6. (См. Ответ)
Марганец Мn (побочная подгруппа VII группы)
В побочную подгруппу VII группы входят элементы марганец Мn, технеций Те, рений Re. Из них наиболее распространенным и широко применяемым элементом является марганец Мn.
Заряд ядра марганца + 25, атомный вес 50,94. Распределение электронов по энергетическим уровням (+25); 2, 8, 13, 2.
Электронная конфигурация марганца внешнего и пред внешнего слоев 3s23p63d54s2.
Марганец в природе встречается в виде разнообразных соединений.
Наиболее часто используемой рудой являются пиролюзит МnO2 и некоторые другие.
Очень часто марганец сопутствует железу и при выплавке чугуна и стали сплавляется с ними.
В виде этих сплавов марганец в основном и находит применение.
Марганец принадлежит к числу тяжелых металлов, его плотность 7,2, температура плавления 1247°, температура кипения 2146°.
Марганец довольно устойчив к коррозии на воздухе, так как покрывается защитной оксидной пленкой. В ряду напряжений марганец стоит левее водорода.
При нагревании мелкораздробленный марганец даже реагирует с водой, образуя гидроокись и водород:
Мn + 2Н2O = МO(ОН)2 + H2
Он очень активно вытесняет водород из кислот (например, из соляной и разбавленной серной).
Азотная кислота окисляет марганец до разных степеней окисления.
Марганец образует ряд окислов, в которых проявляет различные степени окисления:
- МnО — окись марганца — окисел основного характера, ему соответствует гидроокись Мn(ОН)2.
- Двуокись марганца МnO2 — окисел с амфотерными свойствами, ему соответствует гидроокись Мn(ОН)4 — вещество также амфотерного характера.
- Высший окисел Мn2O7 носит название марганцевого ангидрида, имеет ярко выраженные кислотные свойства и является очень сильным окислителем.
Высшему окислу Мn2O7 соответствует марганцевая кислота НМnO4— сильная, но неустойчивая, существующая только в. разбавленных растворах.
Соли марганцевой кислоты называются перманганатами, например КМnO4 — перманганат калия, широко используемый в лаборатории окислитель.
В аналитической химии подкисленные растворы КМnO4 используют в методе объемного количественного анализа, который называется перманганатометрией.
Степень восстановления марганца, входящего в состав перманганата, зависит от условий, в которых проводится реакция, в частности от среды.
Перманганат калия в медицине применяют как антисептическое средство в качестве полосканий и промываний, примочек при ожогах.
➡️ 53. Изобразите схему строения атома марганца, электронную конфигурацию его внешнего и пред внешнего слоев, а также распределение электронов по орбиталям. (См. Ответ)
54. Опишите свойства металлического марганца, приведя соответствующие уравнения реакций.
55. Охарактеризуйте свойства соединений Мn+7, приведя уравнения реакций.
56. Укажите, где применяются марганец и его соединения. (См. Ответ)
Статья на тему Побочная подгруппа V группы


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.