Соли аммония
Соли аммония — вещества очень своеобразные. Все они легко разлагаются, причем некоторые самопроизвольно, пример карбонат аммония:
(NH4)2CО3 = 2NH3 + Н2О + СО2 (реакция ускоряется при нагревании).
Другие соли, например хлорид аммония (нашатырь), возгоняются при нагревании, т. е. сначала разлагаются на аммиак и хлористый водород под действием нагревания.
А при понижении температуры вновь на холодных частях сосуда образуется хлорид аммония:
NH4Cl (нагревание) ⇄ (охлаждение) NH3 + НСl
Нитрат аммония при нагревании разлагается на закись азота и воду:
NH4NО3 = N2О + Н2О
Нитрит аммония NH4NО2 разлагается при нагревании с образованием азота и воды, поэтому им пользуются в лаборатории для получения азота.
При действии на соли аммония щелочей выделяется аммиак:
NH4Cl + NaOH = NaCl + NH3 + H2О
Выделение аммиака — характерный признак для распознавания солей аммония, иногда это используется для его получения.
Все соли аммония являются соединениями комплексного характера.
Применение
Аммиак и соли аммония находят широкое применение. Аммиак используется как сырье для получения азотной кислоты и ее солей, а также солей аммония, которые служат хорошими азотными удобрениями.
Таким удобрением являются сульфат аммония (NH4)2SО4 и особенно нитрат аммония NH4NО3 или аммиачная селитра, в состав молекулы которой входят два атома азота: один аммиачный, другой нитратный.
Растения вначале усваивают аммиачный азот, и затем нитратный.
Этот вывод принадлежит основоположнику русской агрохимии акад. Д. Н. Прянишникову, посвятившему свои труды физиологии растений и обосновавшему значение минеральных удобрений в сельском хозяйстве.
Аммиак в виде нашатырного спирта применяется в медицине. Жидкий аммиак используется в холодильных установках.
Хлорид аммония применяется для изготовления сухого гальванического элемента Лекланше.
Смесь нитрата аммония с алюминием и углем, называемая аммоналом, является сильным взрывчатым веществом.
Карбонат аммония применяется в кондитерской промышленности как разрыхлитель теста.
■ 25. На каком свойстве карбоната аммония основано его использование для разрыхления теста? (См. Ответ)
26. Как обнаружить в составе соли ион аммония?
27. Как осуществить ряд превращений:
N2 ⇄ NH3 → NO
↓
NH4NО3
Интересный факт о солях аммония: по одним из сведений данное вещество получило свое наименование от древнеегипетского слова “амониан”. По второй версии название он получил благодаря оазису Аммона, который располагается в Северной Африке.
Кислородные соединения азота
Азот образует с кислородом несколько соединений, в которых проявляет различные степени окисления.
Существует закись азота N2О, или, как ее называют, «веселящий газ». В ней азот проявляет степень окисления + 1.
В окиси азота NO азот проявляет степень окисления + 2, в азотистом ангидриде N2О3 — + 3, в двуокиси азота NО2 — +4, в пятиокиси азота, или азотном ангидриде, N2О5 — +5.
Закись азота N2О — несолеобразующий окисел. Это газ, довольно хорошо растворимый в воде, но в реакцию с водой не вступающий.
Закись азота в смеси с кислородом (80% N2O и 20% О2) производит наркотизирующее действие и применяется для так называемого газового наркоза, преимущество которого в том, что он не имеет длительного последействия.
Остальные окислы азота сильно ядовиты. Ядовитое действие их сказывается обычно через несколько часов после вдыхания.
Первая помощь состоит в приеме внутрь большого количества молока, вдыхании чистого кислорода, пострадавшему должен быть обеспечен покой.
■ 28. Перечислите возможные степени окисления азота и окислы, отвечающие этим степеням окисления.
29. Какие меры первой помощи следует принимать при отравлениях окислами азота? (См. Ответ)
Оксид азота NО
Наиболее интересными и важными окислами азота являются окись и двуокись азота.
Окись азота NО образуется из азота и кислорода при сильных электрических разрядах. В воздухе во время грозы наблюдается иногда образование окиси азота, но в очень небольших количествах.
Окись азота бесцветный газ, не имеющий запаха. В воде окись азота нерастворима, поэтому ее можно собирать над водой в тех случаях, когда получение ведется лабораторным способом.
В лаборатории окись азота получают из умеренно концентрированной азотной кислоты действием ее на медь:
HNО3 + Сu → Cu(NO3)2 + NO + Н2О
Окись азота можно получить и другими способами, например в пламени электрической дуги:
N2 + O2 ⇄ 2NO.
В производстве азотной кислоты окись азота получают каталитическим окислением аммиака.
Окись азота является несолеобразующим окислом. Она легко окисляется кислородом воздуха и превращается при этом в двуокись азота NO2.
Если окисление производить в стеклянном сосуде, то бесцветная окись азота превращается в бурый газ — двуокись азота.
■ 30. При взаимодействии меди с азотной кислотой выделилось 5,6 л окиси азота. Рассчитайте, сколько прореагировало меди и сколько образовалось соли. (См. Ответ)
Двуокись азота NO2
Двуокись азота NO2 — бурый газ с характерным запахом. Хорошо растворяется в воде, так как реагирует с водой по уравнению:
3NO2 + Н2O = 2HNO3 + NO
В присутствии кислорода можно получить только азотную кислоту:
4NO2 + 2Н2О + O2 = 4HNO3
Молекулы двуокиси азота NO2 довольно легко соединяются попарно и образуют четырехокись азота N2O4 — бесцветную жидкость.
Структурная формула которой четырехокись азота N2O4
Этот процесс происходит на холоде. При нагревании четырехокись азота вновь переходит в двуокись.
Двуокись азота — кислотный окисел, так как может реагировать с щелочами, образуя соль и воду.
Однако вследствие того, что атомы азота в модификации N2O4 имеют различное число валентных связей, при взаимодействии двуокиси азота со щелочью образуются две соли — нитрат и нитрит:
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
Получают двуокись азота, как уже говорилось выше, окислением окиси:
2NO + О2 = 2NO2
Кроме того, двуокись азота получают действием концентрированной азотной кислоты на медь:
Сu + 4HNO3 (конц.) = Cu(NO3)2 + 2NO2 + 2H2O
или лучше прокаливанием нитрата свинца:
2Pb(NO3)2 = 2РbO + 4NO2 + О2
■ 31. Перечислите способы получения двуокиси азота, приведя уравнения соответствующих реакций. (См. Ответ)
32. Изобразите схему строения атома азота в степени окисления +4 и объясните, каким должно быть его поведение в окислительно-восстановительных реакциях.
33. В концентрированную азотную кислоту поместили 32 г смеси меди и окиси меди. Содержание меди в смеси 20%. Какой объем какого газа при этом выделится. Сколько грамм-молекул соли при этом получается? (См. Ответ)
Азотистая кислота и нитриты
Азотистая кислота HNO2 — очень слабая неустойчивая кислота. Она существует лишь в разбавленных растворах (степень диссоциации а = 6,3% в 0,1 н. растворе).
Азотистая кислота легко разлагается с образованием окиси и двуокиси азота:
2HNO2 = NO + NO2 + Н2O.
Степень окисления азота в азотистой кислоте +3. При такой степени окисления условно можно считать, что с внешнего слоя атома азота отдано 3 электрона и еще осталось 2 валентных электрона.
В связи с этим для N+3 в окислительно-восстановительных реакциях существуют две возможности: он может проявлять как окислительные, так и восстановительные свойства в зависимости от того, в какую среду—окислительную или восстановительную — попадает.
Соли азотистой кислоты называются нитритами.
Действуя на нитриты серной кислотой, можно получить азотистую кислоту:
2NaNO2 + H2SO4 = Na2SO4 + 2HNO2.
Нитриты представляют собой соли, довольно хорошо растворимые в воде.
Как и сама азотистая кислота, нитриты могут проявлять окислительные свойства при реакции с восстановителями, например:
NaNO2 + KI + H2SO4 → I2 + NO…
➡️ Найти конечные продукты и расставить коэффициенты на основе электронного баланса попытайтесь самостоятельно.
Поскольку выделяющийся йод легко обнаружить с помощью крахмала, данная реакция может служить способом обнаружения даже незначительных количеств нитритов в питьевой воде, присутствие которых нежелательно из-за ядовитости.
С другой стороны, нитритный азот может окисляться до N+5 под действием сильного окислителя:
NaNO2 + K2Cr2O7 + H2SO4 → NaNO3 + Cr2(SO4)3 + …
➡️ Остальные продукты реакции найдите самостоятельно, составьте электронный баланс и расставьте коэффициенты.
■ 34. Закончите уравнение.
HNO2 + KMnO4 + H2SO4 → … (N+5, Мn+2).
35. Перечислите свойства азотистой кислоты и нитритов. (См. Ответ)
Азотная кислота
В лаборатории обычно поступает 65% HNO3 с плотностью 1,40.
Азотная кислота дымит на воздухе, так как ее пары, поднимаясь в воздух и соединяясь с парами воды, образуют капельки тумана. Азотная кислота смешивается с водой в любых соотношениях.
Она имеет резкий запах, легко испаряется, поэтому переливать концентрированную азотную кислоту следует лишь под тягой.
При попадании на кожу азотная кислота может причинить сильные ожоги. Небольшой ожог дает о себе знать характерным желтым пятном на коже. Сильные ожоги могут вызвать образование язв.
При попадании на кожу азотной кислоты ее следует быстро смыть большим количеством воды, а затем нейтрализовать слабым раствором соды.
Концентрированная 96—98% азотная кислота поступает в лабораторию редко и при хранении довольно легко, особенно на свету разлагается по уравнению:
4HNO3 = 2Н2O + 4NO2 + O2
Она постоянно окрашена двуокисью азота в желтый цвет.
Избыток двуокиси азота и кислород постепенно улетучиваются из раствора, в растворе накапливается вода, а кислота продолжает разлагаться.
В связи с этим концентрация азотной кислоты постепенно уменьшается. При концентрации 65% азотная кислота может сохраняться длительное время.
Азотная кислота является одним из сильнейших окислителей. Она реагирует почти со всеми металлами, но без выделения водорода.
Ярко выраженные окислительные свойства азотной кислоты оказывают на некоторые металлы (железо, алюминий) так называемое пассивирующее действие. Это особенно характерно для концентрированной кислоты.
При ее воздействии на поверхности металла образуется очень плотная не растворимая в кислотах оксидная пленка, защищающая металл от дальнейшего воздействия кислоты. Металл становится «пассивным».
Однако с большинством металлов азотная кислота реагирует. Во всех реакциях с металлами в азотной кислоте восстанавливается азот и тем полнее, чем разбавлен-нее кислота и чем активнее металл.
Концентрированная кислота восстанавливается до двуокиси азота.
Примером этого может служить реакция с медью:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Разбавленная азотная кислота с медью восстанавливается до окиси азота.
Более активные металлы, например олово, восстанавливают разбавленную азотную кислоту до закиси азота:
Sn + HNO3 → Sn(NO3)2 + N2O
При очень сильном разбавлении с активным металлом, например с цинком, реакция доходит до образования соли аммония:
Zn + HNO3 → Zn(NO3)2 + NH4NO3
➡️ Во всех приведенных схемах реакций расставьте коэффициенты, составив электронный баланс самостоятельно.
■ 36. Почему при хранении в лаборатории даже в хорошо закупоренной посуде концентрация азотной кислоты понижается? (См. Ответ)
37. Почему концентрированная азотная кислота имеет желтовато-бурую окраску?
38. Напишите уравнение реакции разбавленной азотной кислоты с железом. Продуктами реакции являются нитрат железа (III), и выделяется газ бурого цвета.
39. Выпишите в тетрадь все уравнения реакций, характеризующие взаимодействие азотной кислоты с металлами. Перечислите, какие соединения азота, помимо нитратов металлов, образуются в этих реакциях. (См. Ответ)
Многие вещества могут гореть в азотной кислоте, например уголь и фосфор:
С + HNO3 → NO + СО2
Р + HNO3 → NO + H3PO4
Свободный фосфор при этом окисляется до фосфорной кислоты.
Сера при кипячении в азотной кислоте превращается в S+6 и из свободной серы образуется серная кислота:
HNO3 + S → NO + H2SO4
Сложные вещества и азотная кислота
Сложные вещества также могут гореть в азотной кислоте. Например, в азотной кислоте горят скипидар, нагретые древесные опилки.
Азотная кислота может также окислять соляную кислоту. Смесь трех частей соляной и одной части азотной кислоты называется «царской водкой».
Такое название дано потому, что эта смесь окисляет золото и платину, на которые никакие кислоты не действуют.
Реакция протекает по таким стадиям: в самой смеси происходит окисление иона хлора в свободный хлор и восстановление азота до образования хлористого нитрозила:
HNO3 + 3НСl (царская водка) ⇄ Сl2 + 2Н2O + NOCl (хлористый нитрозил)
Последний легко разлагается на окись азота и свободный хлор по уравнению:
2NOCl = 2NO + Сl2
Помещенное в «царскую водку» металлическое золото легко окисляется хлористым нитрозилом:
Au + 3NOCl = АuСl3 + 3NO
Азотная кислота может вступать в реакцию нитрования с органическими веществами. При этом обязательно должна присутствовать концентрированная серная кислота.
Смесь концентрированных азотной и серной кислот, называется нитрующей смесью.
С помощью такой смеси можно получить из глицерина нитроглицерин, из бензола — нитробензол, из клетчатки — нитроклетчатку и т. д.
В сильно разбавленном состоянии азотная кислота проявляет характерные свойства кислот.
■ 40. Примеры типичных свойств кислот применительно к азотной кислоте приведите самостоятельно. Уравнения напишите в молекулярной и. ионной формах. (См. Ответ)
41. Почему склянки с концентрированной азотной кислотой запрещается перевозить упакованными в древесные стружки?
42. При испытании фенолфталеином концентрированной азотной кислоты фенолфталеин приобретает оранжевую окраску, а не остается бесцветным. Чем это объясняется? (См. Ответ)
Получение азотной кислоты
Получить азотную кислоту в лаборатории очень легко. Обычно ее получают путем вытеснения из ее солей серной кислотой, например:
2KNО3 + H2SО4 = K2SО4 + 2HNО3
В промышленности сырьем для получения азотной кислоты служит аммиак.
В результате окисления аммиака в присутствии платинового катализатора образуется окись азота:
4NH3 + 5О2 = 4NO + 6Н2О
Как было указано выше, окись азота легко окисляется кислородом воздуха в двуокись азота:
2NO + О2 = 2NO2
а двуокись азота, соединяясь с водой, образует азотную кислоту и снова окись азота по уравнению:
3NО2 + Н2О = 2HNО3 + NO.
Затем окись азота снова подается на окисление:
Первая стадия процесса — окисление аммиака в окись азота — осуществляется в контактном аппарате при температуре 820°.
Катализатором служат сетки из платины с примесью родия, которые нагревают перед запуском аппарата.
Так как реакция экзотермична, то в дальнейшем сетки нагреваются за счет тепла самой реакции.
Вышедшую из контактного аппарата окись азота охлаждают до температуры около 40°, так как процесс окисления окиси азота идет быстрее при более низкой температуре.
При температуре 140° образующаяся двуокись азота разлагается снова на окись азота и кислорода.
Окисление окиси азота в двуокись осуществляется в башнях, называемых абсорберами, обычно под давлением 8—10 атм.
В них одновременно происходит и поглощение (абсорбция) образующейся двуокиси азота водой. Для лучшего поглощения двуокиси азота раствор охлаждают. Получается 50—60% азотная кислота.
Концентрирование азотной кислоты проводят в присутствии концентрированной серной кислоты в ректификационных колоннах.
Серная кислота образует с имеющейся водой гидраты с температурой кипения более высокой, чем у азотной кислоты, поэтому из смеси довольно легко выделяются пары азотной кислоты.
При конденсации этих паров можно получить 98—99% азотную кислоту. Обычно более концентрированная кислота применяется редко.
■ 43. Запишите в тетрадь все уравнения реакций, происходящих при получении азотной кислоты лабораторным и промышленным способами. (См. Ответ)
44. Как осуществить ряд превращений:
45. Сколько 10% раствора можно приготовить из азотной кислоты, полученной взаимодействием 2,02 кг нитрата калия с избытком серной кислоты? (См. Ответ)
46. Определите молярность 63% азотной кислоты.
47. Сколько азотной кислоты можно получить из 1 т аммиака при 70% выходе?
48. Цилиндр заполнили окисью азота путем вытеснения воды. Затем, не вынимая из воды, под него подвели трубку от газометра и начали пропускать кислород. Опишите, что должно наблюдаться в цилиндре, если избытка кислорода не допускалось. Обоснуйте свой ответ уравнениями реакций. (См. Ответ)

Соли азотной кислоты
Соли азотной кислоты называются нитратами. Нитраты щелочных металлов, а также кальция и аммония называются селитрами.
Например, KNО3 — калийная селитра, NH4NО3 — аммиачная селитра.
Природные залежи нитрата натрия имеются в огромном количестве в Чили, в связи с чем эта соль получила название чилийской селитры.
Рис. 2. Горение угля в расплавленной селитре. 1 — расплавленная селитра; 2 — горящий уголек; 3 — песок.
Соли азотной кислоты, как и она сама, являются сильными окислителями.
Например, соли щелочных металлов при плавлении выделяют кислород по уравнению:
2KNО3 = 2KNO2 + О2
Благодаря этому уголь, сера и другие горючие вещества горят в расплавленной селитре (рис. 62).
Соли тяжелых металлов также разлагаются с выделением кислорода, но по другой схеме.
2Pb(NО3)2 = 2РbО + 4NO2 + О2

Калийная селитра применяется для изготовления черного пороха. Для этого ее смешивают с углем и серой.
Натриевая селитра для этой цели не используется, так как она гигроскопична. Черный порох при поджигании интенсивно сгорает по уравнению:
2KNO3 + 3С + S = N2 + 3CO2 + K2S
Нитраты кальция и аммония — очень хорошие азотные удобрения. В последнее время получил распространение в качестве удобрения и нитрат калия.
Азотная кислота широко применяется в производстве химико-фармацевтических препаратов (стрептоцид), органических красителей, целлулоида, кино- и фотопленок.
Соли азотной кислоты широко используются в пиротехнике.
В природе существует круговорот азота, при котором растения при отмирании возвращают обратно в почву полученный из нее азот.
Животные, питаясь растениями, возвращают азот в почву в виде испражнений, а после смерти их трупы перегнивают и тем самым также возвращают почве полученный от нее азот (рис. 3).
Снимая урожай, человек вмешивается в этот круговорот, нарушает его и тем самым обедняет почву азотом, поэтому приходится вносить азот на поля в виде минеральных удобрений.
■ 49. Как осуществить ряд превращений (См. Ответ)
Быстрые ответы?
Все соли аммония — кристаллические вещества, хорошо растворимые в воде. Большинство из них бесцветны, но некоторые окрашены за счет анионов, например: (NH4)2Cr2O7 – оранжево-красный, (NH4)2CrO4 – желтый
Соли аммония можно распознать с помощью характерной реакции – взаимодействия со щелочами. В результате этих реакций выделяется аммиак, который легко распознается по характерному запаху.
В качестве удобрений. Карбонат аммония используется кондитерами как разрыхлитель теста. Хлорид аммония находит применение при паянии




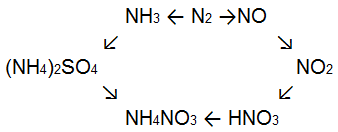
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.