Проверка выполнений заданий и ответов на вопросы
2.
Сходство этих элементов в том, что все они относятся к р-семейству, а также имеют одинаковое число электронных слоев.
Различие состоит в том, что р-орбитали внешнего слоя содержат разное число валентных электронов.
4. Азот имеет молекулярную кристаллическую решетку, о чем свидетельствует низкая температура плавления.
5—6. Ответы на эти вопросы найдите в тексте прочитанного отрывка. Уравнения реакции запишите в тетрадь.
7. Средний молекулярный вес воздуха 29, азота — 28. Следовательно,
8.
9. MN = 1,25 · 22,4 = 28 г.
Атомный вес азота равен 14. Таким образом, 28 : 14=2 атома. Более подробно см. в приложении II, стр. 387—389.
12. Да, можно.
13. Ответ на этот вопрос ищите в тексте прочитанного отрывка текста.
16. Из типов химической связи нам известны ионная, ковалентная, полярная, ковалентная неполярная, донорно-акцепторная.
Водородную связь, образующуюся при ассоциации молекул воды, можно лишь отчасти причислить к химической связи.
17. Электронная пара при ковалентной связи образуется из электронов разных атомов, а донорно-акцепторная связь — при помощи двух электронов атома-донора.
18—19. Ответы найдите в тексте прочитанного отрывка. 2 0. NH4+. 21.—3.
22. Реакции с водой и с кислотами.
23. 2NH3 + H2SО4 = (NH4)2SО4.
Реакцию с фосфорной кислотой напишите самостоятельно.
24. 16,7%; 64,4 г НСl.
27. Из азота аммиак получают прямым синтезом, азот из аммиака — сжиганием аммиака в кислороде. Получить из аммиака окись азота можно каталитическим окислением аммиака.
Получить нитрат аммония из аммиака можно взаимодействием последнего с азотной кислотой.
30. 24 г Сu; 64,5 г нитрата меди.
32. Заряд ядра атома азота равен +7, на первом энергетическом уровне К располагается 2 электрона, на втором уровне L — один.
Схему изобразите самостоятельно.
Внешний электронный слой лишен четырех электронов, остался один. Следовательно, для N+4 более характерны окислительные свойства.
33. 4,48 л NO2, 0,42 моля Cu(NO3)2.
34. Основные продукты реакции HNO3 и MnSO4. Остальное сделайте самостоятельно.
36. При хранении азотная кислота постепенно разлагается с выделением воды, которая накапливается и постепенно разбавляет раствор. Уравнение реакции найдите в тексте.
37. При хранении азотной кислоты происходит разложение с выделением двуокиси азота бурого цвета, которая, растворяясь в азотной кислоте, придает раствору окраску. Уравнение реакции найдите в тексте.
38. Уравнение напишите самостоятельно.
39. Материал для ответа на этот вопрос найдите в тексте параграфа.
42. Фенолфталеин окисляется азотной кислотой. Продукты окисления оранжевого цвета.
45. 126 г 10% раствора азотной кислоты.
46. 14 М.
47. 2,6 т. Попытайтесь решить задачу более коротким путем, исходя из расчета содержания азота в аммиаке и в азотной кислоте. Такой путь не требует написания уравнений реакций всех трех стадий получения азотной кислоты.
48. Сначала газ в цилиндре побуреет, а затем вода начнет подниматься вверх в цилиндр. Уравнения реакций для объяснения этих явлений напишите самостоятельно.
53. 11,07 кг фосфора, 85,1 кг фосфорита.
54. 0,9 т фосфора.
57. Причина различий объясняется различием внутримолекулярного строения и кристаллических структур.
59. Приводим молекулярные уравнения (ионные уравнения напишите самостоятельно):
а) Са(Н2РO4)2 + 2Са(ОН)2 = Са3(РO4)2 + 4Н2O;
б) Са3(РO4)2 + 4Н3РO4 = 3Са(Н2РO4)2;
в) уравнение напишите самостоятельно, процесс идет до образования фосфорной кислоты;
г) уравнение составьте самостоятельно.
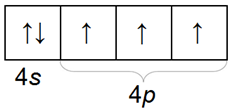
60. (+33) 2, 8, 18, 5 Распределение электронов по орбиталям внешнего слоя:





Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.