Теория:
Степень окисления лития определена и всегда равна +1 в химических соединениях. Это единственное возможное значение для данного элемента (в стандартных условиях).
Но в специализированных органнометаллических соединениях при экстремальных условиях могут наблюдаться более высокие степени окисления.
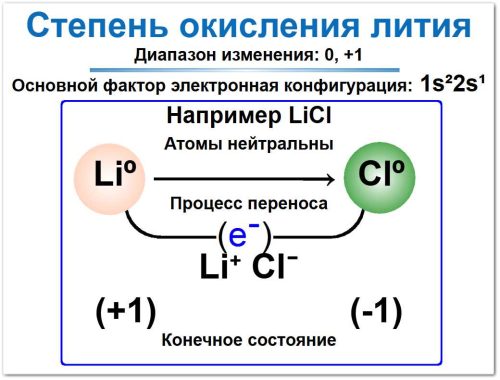
Практический расчет: Для того чтобы определить степень окисления лития, рассмотрим реальную химическую формулу — LiCl.
Запишем значения степеней окисления, обозначив Li как x и используя стандартное значение для Cl (которое, как более электроотрицательный элемент, имеет -1):
СО(Li) : x; СО(Cl): -1
Найти сумму степеней окисления химических элементов и определить значение x для лития:
x + (-1) = 0
x = +1
Степень окисления лития (Li): +1.
Степень окисления хлора (Cl): -1.
(Значение +1 — результат химической реальности и стабильности иона Li+ (конфигурация 1s2)).
Валентность лития в LiCl равна 1.
Обратите внимание: валентность лития, отражает число связей, а степень окисления — условный заряд. В данном случае они совпадают, но это не всегда так для других элементов.
Что влияет в первую очередь на степень окисления лития
- Положение в периодической системе (I группа, 2‑й период)
- Электронная конфигурация лития (1s22s1).
- Квантовые числа валентного электрона.
- Энергия ионизации.
- Электроотрицательность (ЭО).
- Валентность I.
- Типичными реакциями, где Li отдаёт один электрон.
Энергия ионизации лития
У лития две энергии ионизации (по числу электронов: 3):
Первая энергия ионизации (I1) — энергия отрыва одного внешнего электрона (2s1):
Li → Li+ + e—
Значение: 5,39 эВ (или 520,2 кДж/моль). (Очень низкое)
Вторая энергия ионизации (I2) — энергия отрыва второго электрона (от иона Li+, т.е. от стабильной оболочки 1s2):
Li+ → Li2+ + e—
Значение: 75,64 эВ (или 7298 кДж/моль). (Резкий скачок)
Энергия ионизации лития (5,39 эВ) делает его химически активным металлом:
Он легко отдает единственный электрон 2s1 в обычных условиях.
Но с огромным трудом отдает второй электрон.
Обратите внимание: «Третья энергия ионизации» относится уже к иону Li2+, что выходит за рамки обычных химических процессов.
Квантовые числа
Квантовые числа внешнего (валентного) электрона лития (n = 2, l = 0, mₗ = 0, mₛ = ±1/2) отражают незавершенность его электронной оболочки (эти числа описывают состояние электрона в атоме).
Степень окисления лития в подавляющем большинстве случаев = +1 — следствие:
- Незавершённой конфигурации 1s22s1 (наличие 2s1 электрона).
- Низкой первой энергии ионизации (I1), что позволяет легко отдать 2s1.
- Резко высокой второй энергии ионизации (I2), что предотвращает потерю второго электрона.
- Высокой химической активности (стремление к состоянию иона Li+).
Электроотрицательность в определении степени окисления лития
Электроотрицательность (ЭО) — ключевой фактор, объясняющий, почему литий в соединениях всегда имеет степень окисления +1. Разберём механизм.
Как ЭО определяет степень окисления лития
Низкое значение ЭО лития
- По шкале Полинга: ЭО(Li) = 0,98.
- Это одно из самых низких значений среди всех элементов, что означает: атом лития крайне слабо притягивает электроны и легко их отдаёт.
Резкий контраст с типичными неметаллами
Например, ЭО хлора (Cl) = 3,2; кислорода (O) = 3,5; фтора (F) = 4,0.
В соединении LiCl разница ЭО: 3,2 − 0,98 = 2,22. Это гарантирует:
- хлор «перетягивает» электронную пару;
- литий теряет электрон и приобретает заряд +1.
Следствие: однозначная степень окисления +1
- Из‑за низкой ЭО литий не может притягивать электроны к себе — он всегда их отдаёт.
- В любом соединении Li выступает как восстановитель, переходя в ион Li+.
- Поэтому степень окисления лития всегда +1 (в свободных атомах — 0).
Примеры соединений лития всех степеней окисления
У лития единственная характерная степень окисления в соединениях — +1, причем его валентность также равна I (1).
Это обусловлено его электронной конфигурацией (1s2 2s1) и положением в I группе периодической системы:
- Хлорид лития — LiCl.
- Оксид лития — Li2O.
- Гидроксид лития — LiOH.
- Карбонат лития — Li2CO3.
- Сульфат лития — Li2SO4.
Пример решения, задача:
▶️ Дано:
Соединение бромид лития (LiBr)
⌕ Найти:
Определение степени окисления на примере бромида лития (LiBr)
✨ Решение:
Степень окисления (СО) в соединении LiBr (бромид лития) определяется электроотрицательностью двух элементов:
СО(Li) + СО(Br) = 0
(+1) + СО(Br) = 0
СО(Br) = -1
СО (Br): -1
✅ Ответ:
В молекуле бромида лития (LiBr):
- Степень окисления лития (Li) равна +1.
- Степень окисления брома (Br) равна -1.
Часто задаваемые вопросы:
+1 — единственное характерное значение в химических соединениях.
В свободном металлическом состоянии (Li0) степень окисления равна 0.
Других устойчивых степеней окисления для лития не существует — даже в экзотических условиях.
Литий относится к щелочным металлам (группа I) периодической системы.
На внешнем уровне — 1 электрон (2s1), который легко отдаётся из‑за низкой энергии ионизации.
После отдачи электрона образуется ион Li+ с конфигурацией 1s2 (как у гелия).
Это делает степень окисления +1 единственно возможной в соединениях.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.