Теория:
Степень окисления натрия (Na) — это условный заряд атома, который он приобретает, когда этот единственный электрон полностью уходит к более сильному партнёру, поэтому СО натрия равна +1.
Для натрия эти значения совпадают, но описывают разные химические свойства.
Когда бывает иначе:
- 0 — если натрий в чистом виде (металлический Na).
- −1 — крайне редко, в особых химических соединениях (в обычной жизни почти не встречается).
Как определить степень окисления натрия (Na)
Степень окисления (СО) натрия (Na) определяется его фундаментальными свойствами.
Во всех своих соединениях натрий проявляет только одну стабильную степень окисления: +1.
Вот как это обосновывается по вашим критериям:
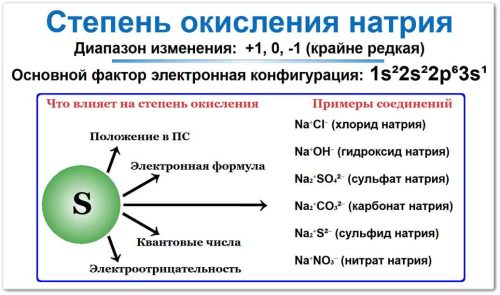
Положение в Периодической Системе
Натрий находится в 1-й группе (главная подгруппа, IA) и 3-м периоде.
Высшая СО: Равна номеру группы (I) и составляет +1.
Низшая СО: Натрий является металлом, поэтому отрицательную СО он не проявляет.
Его единственная стабильная СО — +1.
Электронная формула
Полная формула: 1s2 2s2 2p6 3s1
Валентный слой: 3s1 (один электрон).
Чтобы достичь стабильной, полностью заполненной конфигурации ближайшего благородного газа (Неона, 2s2 2p6), натрию достаточно отдать этот единственный 3s-электрон.
Отдача этого электрона приводит к образованию стабильного катиона Na+, то есть к СО = +1.
Квантовые числа
Квантовые числа подтверждают, что валентный электрон натрия находится в состоянии с низкой энергией связи, что облегчает его отдачу.
Главное квантовое число (n=3): Валентный электрон находится на третьем энергетическом уровне.
Побочное квантовое число (l = 0): Электрон находится на s-орбитали (сферической формы).
Обоснование СО = +1:
Поскольку на уровне n=3 всего один электрон (3s1), ему энергетически выгодно покинуть атом.
Для натрия невозможно проявлять более высокие СО (например, +2), так как для этого потребовалось бы оторвать электрон от стабильного внутреннего уровня (2p6), что требует колоссальной энергии.
Электроотрицательность (ЭО)
Электроотрицательность натрия (ЭО ≈ 0,93) является очень низкой (одна из самых низких в таблице).
Следствие: Натрий почти всегда выступает в роли сильного восстановителя.
В любом соединении (даже с водородом, ЭО ≈ 2,20), натрий всегда отдаёт свой единственный валентный электрон.
Поскольку все остальные элементы, кроме франция и цезия, имеют более высокую ЭО, натрий всегда принимает положительную СО +1.
Почему степень окисления натрия +1
Степень окисления (СО) натрия (Na) всегда равна +1 по двум ключевым причинам, связанным с его атомной структурой и энергетикой:
Электронная структура (стремление к стабильности)
Натрий находится в 1‑й группе (IA) Периодической системы.
Его валентная электронная конфигурация — 3s1, то есть на внешнем уровне находится один‑единственный электрон.
Ближайший благородный газ — неон (Ne) — имеет крайне стабильную, полностью заполненную оболочку (2s2 2p6).
Натрий энергетически выгодно отдаёт этот один валентный электрон, чтобы получить конфигурацию неона.
Отдавая один электрон, атом натрия превращается в стабильный катион Na+, тем самым принимая степень окисления +1.
Примеры соединений натрия (СО = +1)
| Соединение | Формула | Краткое описание |
|---|---|---|
| Хлорид натрия | Поваренная соль; широко используется в быту и промышленности | |
| Гидроксид натрия | Едкий натр; сильное основание, применяется в химии и производстве | |
| Оксид натрия | Образуется при окислении металла; реагирует с водой с образованием щёлочи | |
| Сульфат натрия | Используется в производстве стекла, бумаги, стиральных порошков | |
| Нитрат натрия | Селитра; применяется как удобрение и в пищевой промышленности | |
| Карбонат натрия | Кальцинированная сода; используется в стекольном и мыловаренном производстве |
Пример решения, задача:
▶️ Дано:
Соединение хлорид натрия NaCl
⌕ Найти:
Определите степень окисления (СО) в хлориде натрия NaCl в соединении.
✨ Решение:
В любом соединении сумма степеней окисления всех атомов равна нулю.
Для NaCl: СО(Na) + СО(Cl) = 0
Учтём степень окисления хлора
Хлор (Cl) в хлоридах имеет степень окисления −1.
Подставим значения и решим уравнение
СО(Na) + (−1) = 0
СО(Na) = +1
✅ Ответ:
Степень окисления хлорида натрия NaCl равно +1.
Часто задаваемые вопросы:
+1. Натрий — щелочной металл (группа IA), поэтому в соединениях всегда отдаёт один внешний электрон.
Примеры: NaCl, NaOH, Na2SO4.
0 — в свободном (металлическом) состоянии;
−1 — крайне редко, в особых натрийорганических соединениях;
+2 и выше — невозможно (отрыв второго электрона энергетически невыгоден).
Если это чистый Na → СО = 0.
Если Na в составе соединения → почти всегда СО = +1.
Проверьте баланс: сумма степеней окисления в молекуле должна быть 0.
Пример для NaCl:
СО(Na) + СО(Cl) = 0
СО(Na) + (−1)= 0 ⇒ СО(Na) = +1

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.