Теория:
Степень окисления водорода — это условный (формальный) заряд атома водорода в соединении, определяемый в рамках модели, где все ковалентные связи считаются ионными.
При таком расчёте:
- Электрон приписывается более электроотрицательному атому.
- Степень окисления численно равна количеству «отданных» или «принятых» электронов.
Например, в H2O водород имеет степень окисления +1, так как электрон смещён к кислороду.
Для водорода это даёт:
+1, если атом водорода отдаёт электрон (типично для соединений с неметаллами, например H2O, HCl).
−1, если атом водорода принимает электрон (в гидридах металлов, например NaH, CaH2).
Как определить степень окисления водорода
Степень окисления водорода (СО H) определяется по правилу электроотрицательности и зависит от того, с каким элементом он образует связь.
Знак СО зависит от электроотрицательности элементов: электроны смещаются к более электроотрицательному атому.
-
Если водород связан с более электроотрицательным элементом (O, Cl), его СО = +1.
-
Если водород связан с менее электроотрицательным элементом (Na, Ca), его СО = −1.
Рассмотрим три типовых случая:
- В соединениях с неметаллами.
- В соединениях с металлами (гидридах).
- В простом веществе (H2)
В соединениях с неметаллами водород обычно имеет СО = +1.
Почему: неметаллы (O, N, Cl и др.) более электроотрицательны, поэтому «притягивают» электрон от водорода.
Примеры:
H2O (вода): H +1, O −2;
HCl (хлороводород): H +1, Cl −1;
NH₃ (аммиак): H +1, N −3.
В соединениях с металлами (гидридах) водород имеет СО = −1.
Почему: металлы менее электроотрицательны, поэтому электрон «смещается» к водороду.
Примеры:
NaH (гидрид натрия): Na +1, H −1;
CaH2 (гидрид кальция): Ca +2, H −1;
LiH (гидрид лития): Li +1, H −1.
В простом веществе (H2) степень окисления водорода равна 0.
Почему: в молекуле H2 связь ковалентная неполярная — электроны не смещаются ни к одному из атомов.
Почему степень окисления водорода -1, 0, +1
Степень окисления +1 (положительная)
Значение СО = +1 является наиболее характерным для водорода и проявляется в подавляющем большинстве его соединений.
Водород приобретает СО = +1, когда связан с более электроотрицательными неметаллами (O, N, Cl, S, и др.).
В этих парах атомов электронная плотность смещается от водорода к атому-партнеру, что условно придает ему положительный заряд.
Пример
| Соединение | СО(H), причина |
| Н2О | +1; O более электроотрицателен, чем H |
| HCl | +1; Cl более электроотрицателен, чем H |
| NH3 | +1; N более электроотрицателен, чем H |
Степень окисления -1 (Отрицательная)
Значение СО = -1 является исключением и проявляется только в особых соединениях.
Почему -1?
Водород приобретает СО = -1 в гидридах металлов (NaH, CaH2).
Металлы (Na, Ca, K) являются менее электроотрицательными элементами в сравнении с водородом.
Следовательно, в этом случае водород действует как более электроотрицательный элемент, притягивает электронную плотность и приобретает условный отрицательный заряд.
Пример
| Соединение | СО(H), причина |
| NaH | -1; Na менее электроотрицателен, чем H |
| CaH2 | -1; Ca менее электроотрицателен, чем H |
Степень окисления 0 (нейтральная)
СО = 0 проявляется в виде простого вещества (H2).
В молекуле H2 два атома водорода абсолютно идентичны, и их электроотрицательность одинакова.
Электронная пара распределена симметрично, поэтому смещения не происходит, и СО каждого атома остается нулевой.
Зависимость степени окисления водорода от электронной конфигурации
Степень окисления водорода (−1, 0, +1) напрямую определяется его электронной конфигурацией 1s1.
Она жёстко ограничивает возможные СО водорода тремя значениями.
Направление смещения электрона (к более электроотрицательному атому или от него) и даёт конкретное значение степени окисления.
1s¹ — исходная конфигурация
У водорода 1 электрон на 1‑м уровне. Отсюда три сценария:
- Отдать электрон → СО = +1;
- Принять электрон → СО = −1;
- Сохранить электрон → СО = 0.
СО = +1 (отдал электрон)
Когда: в соединениях с неметаллами (O, N, Cl и др.).
Неметаллы более электроотрицательны — смещают электрон от H.
Пример: H₂O (H +1).
Электронная схема: H (1s1) → H⁺ (1s0).
СО = −1 (принял электрон)
Когда: в гидридах металлов (NaH, CaH2).
Металлы менее электроотрицательны — электрон смещается к H.
Пример: NaH (H −1).
Электронная схема: H (1s1) + e⁻ → H⁻ (1s2).
СО = 0 (электрон не смещён)
Когда: в простом веществе H2.
Почему: связь H–H неполярная, электронная плотность равномерна.
Пример: H2.
Электронная схема: H (1s1) … H (1s1).
Почему только −1, 0, +1?
Максимум отдать: 1 электрон → +1.
Максимум принять: 1 электрон (до заполнения 1s‑орбитали) → −1.
Без смещения → 0.
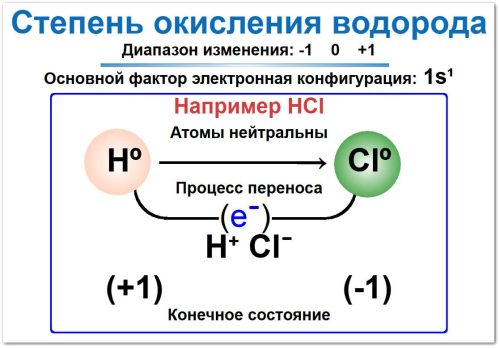
Степень окисления на примере хлороводорода HCl
Водород (H)
Водород в соединениях с неметаллами имеет СО +1.
Хлор (Cl) является более электроотрицательным неметаллом, чем водород.
Поэтому в паре H—Cl единственный валентный электрон водорода условно переходит к хлору, и водород приобретает заряд +1.
СО (H): +1
Хлор (Cl)
Сумма степеней окисления всех атомов в нейтральной молекуле должна быть равна нулю.
СО(H) + СО(Cl) = 0
(+1) + СО(Cl) = 0
СО(Cl) = -1
Пример решения, задача:
▶️ Дано:
Соединение вода Н2О.
⌕ Найти:
Определить степень окисления (СО) в соединении.
✨ Решение:
Запишем формулу и обозначим неизвестную СО водорода.
Обозначим СО Водорода как x.
Н2хО-2
Составим уравнение, используя правило суммы СО.
Сумма СО всех атомов в нейтральной молекуле равна 0.
В молекуле 2 атома водорода и 1 атом кислорода.
(2 х СОН) + (1 х СОО) = 0
Подставим известные значения и решим уравнение относительно x.
(2 • х) + (1 • (-2)) = 0
2х — 2 = 0
2х = +2
х = +1
✅ Ответ:
Степень окисления водорода (СОH) в воде (H2O) равна +1.
Часто задаваемые вопросы:
Из‑за электронной конфигурации 1s¹. Водород может:
Отдать свой электрон → +1 (в соединениях с неметаллами);
Принять электрон → −1 (в гидридах металлов);
Сохранить электрон → 0 (в молекуле H₂).
В гидридах металлов (NaH, CaH₂). Металл менее электроотрицателен, поэтому электрон смещается к водороду, и он формально получает заряд −1.
Кислород более электроотрицателен, чем водород. Электрон смещается от H к O, поэтому водород условно «теряет» электрон и получает СО = +1.