Руды вольфрама
Руды, содержащие 0,5—2% WO3, бывают комплексными по молибдениту MoS2, касситериту SnO2 и другим ценным составляющим. Основной способ обогащения вольфрамитовых руд — гравитация, а шеелитовых — флотация. Крупновкрапленный вольфрамит отделяют от шеелита и касситерита магнитной сепарацией в сильном поле; схемы разнообразны и часто сложны.
Концентраты вольфрамито-гюбнеритового типа, в которых более 65% WO3, ~10% SiO2 и мало фосфора, идут на выплавку ферровольфрама. Подобное сырье с 60% WO3 и шеелитовые концентраты (#5%W03) направляют на производство твердых сплавов и чистого вольфрама. Обычные примеси в них:
Примесь Si02 P S As Sn Сu Mo
Концентрация, % . До 10 0,04-0,2 0,5-0,8 0,1-0,2 0,2-1 0,2 до 0,06
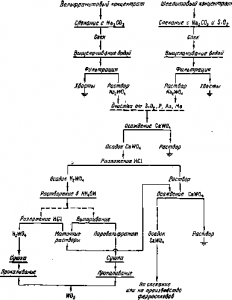
Рис. Схема переработки вольфрамовых концентратов
Разложение вольфрамовых концентратов
Вольфрамитовые и шеелитовые концентраты перерабатывают сходными способами, которые можно представить общей схемой (рис.).
Вольфрамитовые концентраты спекают или сплавляют с содой, проводя следующие реакции:
4FeWО4 + 4Na2O3 + О2 = 4Na2WО4 + 2Fe2О3 + 4CO2, 6MnWО4 + 6Na2CO3 + О2 = 6Na2WО4 + 2Mn3О4 + 6CO2
спеки или сплав выщелачивают водой.
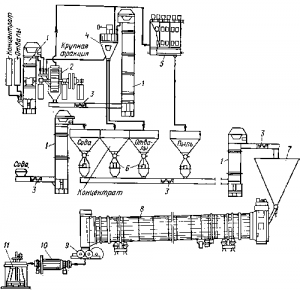
Рис. 2. Схема цепи аппаратов для спекания и выщелачивания вольфрамовых концентратов:
1 — элеватор; 2 — шаровая мельница; 3 — шнек; 4 — воздушный сепаратор; 5 — электрофильтр; 6 — дозаторы; 7 — бункер; 8 — печь; 9 — валковая дробилка; 10 — барабанный выщелачиватель; 11 — мешалка
Шеелит тоже можно разложить содой, однако при выщелачивании CaWO4 он снова выпадает в осадок:
CaWO4 + Na2CO3 = СаО + Na2WO4 + СО2
WO24— + СаО + Н2О = 2OН— + CaWO4,
Учитывая это, в шихту добавляют кварцевый песок связывающий известь в труднорастворимый силикат кальция:
CaWО4 + Na2CO3 + SiO2 = Cа2SiO3 + Na2WO4 + CO2.
Примеси переходят в Sa2SiO3, Na3PO4, Na3AsO4, Na2MoO4. В зависимости от температуры (800—950° С) и избытка соды получают спек или расплав; иногда для окисления добавляют селитру. Плавку при малых масштабах производства проводят
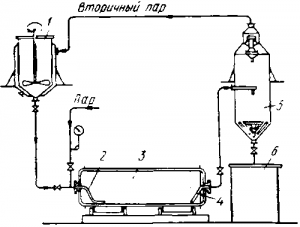
Рис. 3 . Схема автоклавной установки для выщелачивания шеели-товых концентратов:
1 — мешалка для приготовления пульпы; 2 — подача в автоклав пульпы и пара; 3— автоклав; 4 — разгрузочная труба; 5—сепаратор пара; 6 — сборник выщелоченной пульпы в отражательных печах, а спекание — в трубчатых вращающихся (рис. 2 ).
Шеелитовые концентраты разлагают также в автоклавах раствором соды по способу В. С. Сырокомского и И. Н. Масленицкого:
CaWO4 + Na2CO3 = СаCO3 + Na2WO4,
Результат нашего расчета выражен в активностях при обычной температуре. По опытным данным, константа равновесия реакции (325) в концентрациях имеет следующие величины при исходном молярном отношении 9 =CaWO4: Na2CO3=1:
Температура, °С . 90 75 200 225 250
К……. 0,46 1,21 1,45 1,56 1,85
Зависимость К от 0 объясняется изменением ионной силы раствора, а с ним и коэффициента активности. При увеличении 0 до 2. Помимо того, дополнительного расхода соды требуют реакци с примесями, а скорость достижения равновесия их понижена отложение твердого СаСО3 на поверхности частиц шеелита. Соду экономят, проводя двустадийное выщелачивание с оборачиванием растворов, скорость взаимодействия увеличивают тонким измельчением концентрата до 0.074 мм. Автоклавы обогревают острым паром, поддерживая температуру до 250° С при давление 263•104 Па. Схема цепи аппаратов показана на рис.3 .
Шеелитовые концентраты разлагают и раствором фторида натрия в автоклавах по реакции:
CaWО4 + 2NaF = Na2WО4 + CaF2,
По опытным данным, константа равновесия, выраженная в концентрациях
при температуре 225° С, в зависимости от избытка NaF, в пределах 2,58— 24,55. Фторид натрия более энергичный реагент, чем сода. Это видно, в частности, из показателей равновесия сходных реакций. Извлечение в раствор в обоих случаях достигает 99%; однако расход фторида натрия меньше, получаемые растворы при этом чище. Вместе с тем NaF дороже соды, а растворы, содержащие фтор, перерабатывать труднее.
Вольфрамитовые концентраты можно разлагать раствором щелочи при температуре 110° С:
Me11 WО4 + 2NaOH = Na2WО4 + Me (OH)2.
Продувка пульпы воздухом способствует выщелачиванию, убыль изобарного потенциала при этом возрастает на величину окислительно-восстановительного потенциала соответствующей системы и образования Fe(OH)3 или Мn(ОН)3. Способ пригоден только для очень богатых и чистых концентратов; примесь SiO2 дает трудно фильтруемые гели и замедляет реакции из-за осаждения SiO2•nН2О на поверхности. Термодинамические расчеты здесь затруднены отсутствием исходных данных для вольфрамита. Шеелит так выщелачивать нельзя, это видно из реакции.
Статья на тему Руды вольфрама

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.