Двуокись титана
Вместе с титаном в раствор переходит железо (II) и железо (III), последнее восстанавливают металлической стружкой:
2Fe3+ + Fe = 3Fe2+ .
Константу равновесия реакции легко вычислить из двух окислительно-восстановительных систем:
2Fe3+ 2е = 2Fe2+ ; E0 = 0,77В, Fe — 2e = Fe2+; E0 = —0,42 В,
K = a3Fe2+/a2Fe3+ = 2•1040.
Полнота восстановления достаточно велика, например при aFe2+ = 1 г-ион/л в растворе остается ~10-20 г-ион/л Fe3+, но на практике она ограничена доступом кислорода воздуха. Растворимость FeSO4 в воде при обычных условиях около 19% (по массе), a TiOSO4~54%, поэтому удается
отделить основные количества железа кристаллизацией FeSO4•7H2O. Последующий гидролиз сульфата титанила можно представить так:
ТiO2+ + 2Н2O = ТiО(ОН)2 + 2Н+,
рК = 2pKH2O — pПРTi(он)2 = — 1
Из константы гидролиза при рН —1 найдем
К = a2H+/aTiO2+ = 10
aTiO22+= 10-3 г-ион/л (0,08 г/л).
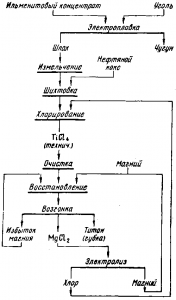
Рис. Краткая схема производства титана из железотитановых концентратов
Конечная кислотность предупреждает осаждение Fe(OH)2,. но для удержания в растворе больших количеств Fe3+ она недостаточна. Этим и обусловлена необходимость возможно более полного восстановления железа. К недостаткам этого способа надо отнести высокий расход серной кислоты, трудность сброса отходов и получение грубозернистой двуокиси.
Производство ТiO2 сжиганием тетрахлорида титана в кислороде при температуре 1000° С и подогреве описывается реакцией:
TiCl4 + O2 = ТiO2 + 2Сl2; ΔZ01273° = -83,38 кДж.
Экономическая оценка этого способа в сравнении с гидрометаллургией зависит от качества сырья и местных условий. В зарубежном мире так получают, от 1/4 До 1/3 ТiO2.
Статья на тему Двуокись титана

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.