СВОЙСТВА ТИТАНА
Будучи элементом IV группы Периодической системы, титан имеет на внешних орбиталях по два d— и s-электрона. Металлу свойственны многочисленные степени окисления: —1, О, II, III, IV и широкая способность к комплексообразованию.
Металл серебристого цвета устойчив в атмосфере до температуры около 500° С, с превышением ее он начинает окисляться. Порошок титана сгорает в двуокись ТiO2 при 500° С, а в азоте — в нитрид TiN при 800° С. Азотная и серная кислоты на металл действуют слабо; в горячей концентрированной соляной кислоте он медленно растворяется и быстро переводится в раствор смесью плавиковой и азотной кислот. Горячими концентрированными растворами и расплавами щелочей титан растворяется с выделением водорода. При нагревании металл, особенно взятый в виде порошка (губки), поглощает кислород, азот и другие газы.
Двуоокись ТiO2 в минералах: рутиле, бруките и анатазе, в зависимости от соответствующей полиморфной модификации имеет плотность от 3840 до 4260 кг/м3. Она плавится при температуре 1870° С; выше 2200° С выделяет кислород, переходя сначала в синий ТiО2 • Тl2О3, а затем в фиолетовый Тi2О3.
Ион Ті4+ в водных растворах существовать не может из-за слишком большого отношения заряда к радиусу. В момент образования гидролизуется, превращаясь в ТiO2+, а вернее в (ТіО)2nn+ имеющий цепочечное строение:
Гидроокись, упрощенно представляемая как Ті(ОН)4, з в действительности TiO2•H2O, сходна с SnO2•тН2O: свежеосажденная (а) растворяется в сильных кислотах, а со временем стареет и становится более инертной (β). Она амфотерна; однако в кислотные, и основные свойства ТiO2•nН2О выражены очень слабо. % Двуоокись и гидроокись при нагревании с концентрированной серной кислотой дают растворимый сульфат титанила:
ТiO2 + H2SO4 = TiOSO4 + Н2О.
Водой он гидролизуется, выделяя белый осадок гидроокиси:
TiOSO4 + (n + 1) Н2O = 2Н+ + TiO2•nH2O + SO24—
Галогениды Ті (IV) соединения — преимущественно ковалентного типа, некоторые сведения о них даны в табл.
Таблица. Некоторые физические свойства галогенидов
| Свойства | TIF4 | TiCl4 | ТiВr4 | ТiI4 |
| Цвет ……. | Бесцветный | Бесцветный | Желтый | Темно—
красный |
| Tпл, ° С | — | -25 | +39 | + 150 |
| т кип, °с | 283 | 136 | 231 | 377 |
Четыреххлористый титан получают из окиси действием хлора в присутствии углерода:
ТiO2 + 2С + 2Сl2 = ТіСl4 + 2СО.
Гидрид ТіН4 —черный порошок, образуемый прокаливанием мелкораздробленного металла в среде водорода при температурах выше 400° С; на воздухе он устойчив, но при поджигании сгорает. ТіН2 служит раскислителем в порошковой металлургии, кроме того, он катализирует некоторые реакции гидрирования органических соединений, а в атомной энергетике пригоден как замедлитель нейтронов.
Карбид ТіС и нитрид TiN — металлоподобные электропроводные вещества, взаиморастворимые в твердом состоянии.
Соединения титана в степени окисления ниже двух известны лишь в составе комплексов, для металлургии пока не интересных.
Комплексные соединения титана вследствие малого заполнения d-орбитали весьма многочисленны и разнообразны. Из них для современной металлургии наиболее важны галогениды типа [TiFe]2-. Соли Na2TiF6 и К2ТiF6 получают растворением ТiO2 в плавиковой кислоте и кристаллизацией после добавления солей щелочных металлов. Растворимость фторотитанатов калия и натрия при 20°С соответственно 2,2 и 6,5% (по массе).
Статья на тему Свойства титана

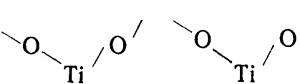
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.