Тетрахлорид титана применяется в химической промышленности, для получения титана, который может быть получен из титан содержащих минералов.
Для этого используют ильменит и рутил.
На большинстве современных предприятий применяется процесс хлорирования в реакторах кипящего слоя для получения тетрахлорида титана.
Производство тетрахлорида титана хлорированием
Хлорирование окислов в общем виде записывается уравнением:
МеОп + пСl2 = MeСl2п + n/2 O2.
Изменение изобарного потенциала будет отрицательным, если ΔZ0MeCl2n —ΔZ0MeOn <0, иными словами, когда сродство металла к хлору больше, чем к кислороду.
Если окисел и хлорид взаимно нерастворимые твердые или жидкие вещества.

Титановый шлак дробят и измельчают (—0,1 мм), очищают от металлического железа магнитной сепарацией, смешивают с мелким нефтяным коксом (—0,15 мм) и сульфитцеллюлозным щелоком в обогреваемом смесителе, а затем брикетируют на валковых прессах.
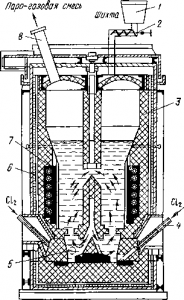
Рис. Шахтный хлоратор непрерывного действия:
1 — загрузочный бункер с золотниковым питателем; 2— свод, охлаждаемый водой; 3 — корпус; 4 — разгрузочный конус; 5 — шнек для выгрузки остатка.
Яйцевидные брикеты прокаливают для удаления влаги и летучих угля при температуре 1250° С или более длительно при 700° С.
После этого в них углерода ~25%, двуокиси титана 60%, а летучих менее 0,2%.
Брикеты еще недавно хлорировали только в шахтных электропечах, а теперь все чаще применяют автогенные хлораторы непрерывного действия (рис.).
Пригодные, однако, для шихт с малыми примесями кальция и магния, не дающих заметных количеств легкоплавкого расплава хлоридов.
Температуру регулируют сходом сыпи — загрузкой и разгрузкой, а также подачей хлора.
Хлорирование в солевом расплаве, не требует брикетирования и его не затрудняет образование легкоплавких хлоридов.
При этом предварительно подсушенную мелкую шихту непрерывно загружают в жидкую ванну смеси солей, составленной, например, из 75%КСl, 10% NaCl, 6%. СаСl2, 6% MgCl2 и нагретую до 800° С.
Снизу подают хлор-воздушную смесь, барботирующую расплав и заставляющую витать в нем частицы шихты. Жидкие соли смачивают уголь, поверхность которого адсорбирует хлор.
Предполагают, что реакции хлорирования протекают на границе раздела восстановителя и расплава, в котором окислы несколько растворимы. Газообразные хлориды собираются в пузырьки, всплывающие на поверхность ванны.
Рис. 2. Хлоратор с расплавом солей:
1 — загрузочный бункер; 2 — шненовый питатель; 3 — футеровка из шамота; 4 — фурмы для подачи хлора; 5 — летка для выпуска расплава; 6 — корпус; 7 —пусковые графитовые электроды; 8 — газоход.
Первое накопление в жидкой фазе железа (III) ускоряет хлорирование, вероятно, путем каталитического действия его комплексов, в частности FeCl4—.
Постепенно густеющий расплав частично выпускают и заменяют свежим, от которого отработанный отличается присутствием до 20% солей железа и марганца, а также взвесей окиси кремния и до 1% двуокиси титана.
Схема хлоратора показана на рис. 2.
Недостаток жидкой ванны наряду с ее несомненными преимуществами — необходимость переработки или обезвреживания отработанных солей, выход которых достигается 1/5 от массы ТiCl4.
Хлориды растворимы в воде и токсичны, поэтому прямой сброс их недопустим.
Хлорирование в кипящем слое обещает быть более прогрессивным пределом; однако в нем еще много трудностей, пока еще не вполне преодоленных.


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.