Кислотами называют соединения, которые содержат, атомы водорода, способные замещаться металлом с образованием солей.
Количество атомов водорода, способных замещаться металлом, определяет основность кислоты бывают кислородсодержащими и бескислородными.
Кислородсодержащие кислоты можно рассматривать как продукт гидратации кислотных оксидов (ангидридов).
Что такое кислоты
Кислотами называются электролиты, диссоциирующие в водных растворах с образованием в качестве катионов только ионов водорода, а в качестве анионов — кислотного остатка.
Например, диссоциация азотной кислоты выражается следующим равенством:
HNО3 ⇄ Н+ + NO3—
В табл. 6 и 7 приведена классификация кислот по составу и основности. 1
Названия кислот зависят от названия центрального атома, образующего кислоту, например:
- H2SО4— серная кислота,
- HNО3 — азотная кислота.
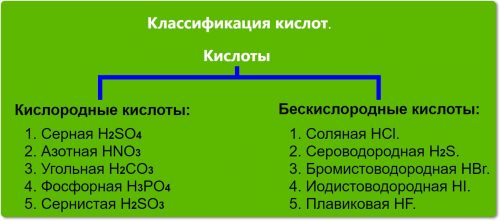
Классификация кислот по составу
Разделяют на кислородные бескислородные кислоты.
Кислородные кислоты:
- Серная H2SО4.
- Азотная HNO3.
- Угольная H2CO3.
- Фосфорная H3PО4.
- Сернистая H2SO3.
- Кремниевая H2SiO3.
Бескислородные кислоты:
- Соляная НСl.
- Сероводородная H2S.
- Бромистоводородная НВr.
- Иодистоводородная HI.
- Плавиковая HF.
Классификация кислот по основности
Разделяют на одноосновные, двухосновные и многоосновные кислоты.
Одноосновные:
- Соляная HCl.
- Азотная HNO3
- Бромистоводородная HBr.
- Йодистоводородная HI
Двухосновные:
- Серная H2SO4.
- Угольная H2CO3.
- Сернистая H2SO3.
- Кремниевая H2SiO3.
Многоосновные:
- Фосфорная H3PO4
- Борная H3BO3.
Если элемент образует две или несколько кислот, то названия отличаются друг от друга окончаниями:
- H2SО4— серная кислота (сера в высшей положительной степени окисления).
- H2SО3 — сернистая кислота (сера в низшей положительной степени окисления).
Среди кислот лишь кислородные кислоты имеют соответствующие им ангидриды.
Например, серной кислоте H2SО4 соответствует серный ангидрид SО3, фосфорной кислоте Н3РО4 — фосфорный ангидрид Р2О5 и т. д.
Если кислота бескислородная, то к названию элемента добавляется окончание «водородный»: H2S — сероводородная кислота, НВr — бромистоводородная кислота и т. д.
Бескислородные кислоты представляют собой летучие водородные соединения элементов главных подгрупп VI— VII группы, растворенные в воде. Ангидридов они, естественно, не имеют.
Они также не могут быть выделены в безводном состоянии.
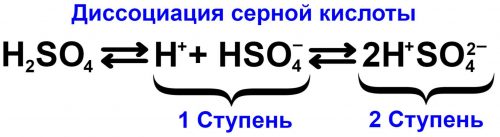
Диссоциация одкоосновных кислот отличается от диссоциации двухосновных и многоосновных кислот.
Двухосновные и многоосновные кислоты диссоциируют ступенчато, например диссоциация серной кислоты протекает практически по следующей схеме
➡️ 100. Напишите, пользуясь периодической системой, формулы следующих кислот:
а) мышьяковой,
б) фтористоводородной,
в) селеновой,
г) хромовой,
д) марганцевой,
е) бромистоводородной,
ж) сероводородной,
з) ванадиевой. (См. Ответ)
К каким группам кислот по составу и по основности они относятся? Напишите уравнения диссоциации этих кислот. Для кислородных кислот найдите ангидриды.
По степени диссоциации кислоты разделяют на сильные, средние и слабые.
Классификация кислот по степени диссоциации
Сильные кислоты:
- Соляная кислота HCl.
- Азотная кислота HNO3.
- Серная кислота H2SO4.
Средние кислоты:
- Фосфорная H3PO4.
- Сернистая H2SO3.
Слабые кислоты:
- Кремниевая H2SiO3.
- Угольная H2CO3.
- Сероводород H2S.
По физическим свойствам большая часть минеральных кислот представляет собой жидкости. Имеется и твердая кислота — фосфорная. Это кристаллическое вещество.
Все кислоты по удельному весу тяжелее воды. Затвердевают они при температурах ниже нуля и смешиваются с водой в любых соотношениях.
Некоторые летучие кислоты имеют запах (HCl, HNO3).
Известны кислоты бесцветные и окрашенные (хромовая кислота Н2СrO4 — желтого цвета; марганцевая кислота НМnO4 — малиновая).
Свойства
Кислородные и бескислородные кислоты обладают общими химическими свойствами.
1. Кислоты действуют на индикаторы:
Лакмус в кислотах становится розовым, фенолфталеин остается бесцветным, а метиловый оранжевый становится красным.
Одинаковое действие кислот на индикаторы объясняется повышенной концентрацией ионов водорода в растворе в связи с диссоциацией кислот.
2. Кислоты вступают в реакцию с металлами:
Zn + 2НСl= ZnCl2 + H2↑
Zn + 2H+ + 2Cl— = Zn2+ + 2Cl—+ H2
Zn + 2H+ = Zn2+ + H2
Реакция с выделением водорода происходит лишь в том случае, если кислота сильная (кроме азотной) и если вступающий в реакцию металл активнее водорода и поэтому может вытеснять его из кислот.
Для того чтобы определить, достаточно ли активен металл, пользуются электрохимическим рядом напряжений металлов.
Впервые этот ряд экспериментальным путем был составлен и изучен русским ученым Н. Н. Бекетовым.
Металлы в этом ряду расположены в порядке убывания их активности. Это связано с энергией, необходимой для отрыва валентных электронов.
Чем активнее металл, тем легче он отдает электроны, тем меньшая энергия для этого требуется. Все металлы, стоящие в этом ряду левее водорода, активнее его и могут восстанавливать его из кислот.
Все металлы, стоящие правее водорода, имеют малую активность и водород из кислот не восстанавливают.
3. Кислоты могут вступать в реакцию с основными окислами:
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
Fe2O3 + 6Н+ + 3SO24— = 2Fe3+ + 3SO24— + 3H2
Fe2O3 + 6H+ = 2Fe3+ 3H2O
4. Реагируют с любыми основаниями (реакция нейтрализации):
Са(ОН)2+ 2НСl = СаСl2+ 2Н2О
Са2+ + 2OН— + 2Н+ + 2Сl— = Са2+ + 2Сl— + 2Н2О
H+ + OH— = H2O
5. Кислоты вступают в реакцию с солями в том случае, если при этом образуется нерастворимый в кислотах осадок или если реагирующая кислота сильнее, чем кислота, образовавшая соль.
Первому условию удовлетворяет реакция:
AgNО3 + НСl = AgCl↓ + HNO3
Ag+ + NO3— + H+ + Cl— = AgCl + H+ + NO3—
Ag+ + Cl— = AgCl
а по второму реакция:
CaCO3 + 2HCl = СаСl2 + H2CO3
CaCO3 + 2H+ + 2Cl— = Ca2+ + 2Cl— + CO2 + H2O
CaCO3 + 2H+ = Ca2+ + CO2 + H2O
Получение кислот
Кислородных
1. Соединением соответствующего ангидрида с водой:
SO3 + Н2О = H2SO4.
2. Вытеснением менее стойкой кислоты из ее соли более стойкой кислотой:
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3
2Na+ + SiO23— + 2H++ SO24— = 2Na+ + SO24— + H2SiO3
2H+ + SiO23— = H2SiO3
Бескислородных
1. Путем прямого синтеза из элементов:
Н2 + Сl2 = 2НСl.
2. Вытеснением менее стойкой кислоты из ее соли более стойкой кислотой:
2NaCl + H2SO4 = Na2SO4 + 2HCl
➡️101. С какими из перечисленных ниже веществ может вступать в реакцию разбавленная серная кислота:
а) железо;
б) сульфат кальция;
в) карбонат натрия;
г) гидроокись цинка;
д) медь;
е) нитрат магния;
ж) окись алюминия;
з) окись углерода (IV)? В тех случаях, когда реакция возможна, напишите ее уравнение в молекулярной и ионных формах.
102. Каким способом, имея окись кремния (IV), едкий натр, воду и серную кислоту, можно получить кремниевую кислоту?
Все уравнения записывать в молекулярной, полной ионной и сокращенной ионной формах в тех случаях, если это реакция между электролитами в растворах. (См. Ответ)
103. Осуществите ряд превращений.
Все уравнения реакций между электролитами в растворе записывайте в молекулярной, полной ионной и сокращенной ионной формах.
104. Сколько едкого натра будет израсходовано на реакцию с 200 г 3% раствора соляной кислоты? (Иногда исходное вещество может быть дано в виде раствора молярной или нормальной концентрации. Ход решения от этого не меняется.)
105. Сколько гидроокиси бария потребуется для полного осаждения сульфат-иона из 200мл 0,1 н. серной кислоты? (См. Ответ)
Список кислот
- Азотная HNO3
- Аминобензойные
- Аминокапроновая
- Аминосалициловые
- Аскорбиновая
- Аспарагиновая
- Ацетилендикарбоновая
- Ацетилсалициловая
- Барбитуровая
- Бензойная
- Бета-Кетонокислоты
- Борная H3BO3
- Валериановые
- Винная
- Галловая
- Галогенкарбоновые
- Глицериновая
- Глутаминовая
- Гликолевая
- Глюкуроновая
- Дикарбоновые
- Дихлорфеноксиуксусная
- Жирные кислоты
- Изолимонная
- Изоникотиновая
- Изофталевая
- Итаконовая
- Карбаминовая
- Карбоновые кислоты
- Кремнефторисоводородная
- Кротоновая
- Лауриновая
- Лимонная
- Липоевая
- Масляная
- Малеиновая и фумаровая
- Малоновая
- Меконовая
- Молочная
- Мочевая
- Муравьиная
- Надуксусная
- Нафталинкарбоновые
- Нафтеновые кислоты
- Никотиновая
- Олеиновая
- Пальмитиновая
- Пангамовая
- Пантотеновая
- Парааминобензойная
- Пеларгоновая
- Пировиноградная
- Полиакриловая
- Пропановой кислоты
- Пропиоловая
- Рицинолевая
- Салициловая
- Серная H2SO4
- Синильная
- Соляная HCl
- Сорбиновая
- Стеариновая
- Сульфаминовая
- Сульфосалициловая
- Тиогликолевая
- Тиоуксусная
- Терефталевая
- Трифторуксусная
- Угольная Н2СО3
- Уксусная CH3COOH
- Фенилуксусная
- Фосфорная
- Фолиевая
- Фталевая
- Фтористоводородная
- Фторуксусная
- Фузидиевая
- Хлоруксусные
- Хромовая
- Хромотроповая
- Хлорная
- Хлорсульфоновая
- Циановая
- Циануксусной
- Циануровая
- Щавелевая
- Щавелевоуксусная
- Этакриновая
- Яблочная
- Янтарная

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.