Химическое равновесие
Многие химические реакции протекают таким образом, что взятые вещества целиком превращаются в продукты реакции, или, как говорят, реакция идет до конца. Так, например, бертолетова соль при нагревании вся без остатка превращается в хлористый калий и кислород:
2КClO3 = 2КСl + 3O2
Обратное получение бертолетовой соли из хлористого калия и кислорода, по крайней мере при известных нам условиях, оказывается невозможным. Такого рода реакции называются практически необратимыми или односторонними.
Иной характер имеет реакция взаимодействия водорода с железной окалиной. Если пропускать водород над накаленной железной окалиной, то последняя превращается в железо, а водород соединяется с кислородом окалины, образуя воду:
Fe3O4 + 4Н2 = 3Fe + 4Н2O
С другой стороны, действуя при такой же температуре водяным паром на порошкообразное железо, можно получить железную окалину и водород. Эта реакция выражается тем же уравнением, что и предыдущая, если читать его справа налево:
3Fe + 4Н2O = Fe3O4 + 4Н2
Таким образом, при одной и той же температуре будут протекать две прямо противоположные реакции: из железной окалины и водорода будут получаться железо и водяной пар, а из последних снова железная окалина и водород.
Процессы, которые при одних и тех же условиях могут итти как в ту, так и в другую сторону, называются обратимыми или двусторонними.
Чтобы показать, что химический процесс обратим, в уравнении реакции заменяют знак равенства двумя стрелками, нацра-вленными в противоположные стороны:
Fe3О4 + 4Н2 ⇄ 3Fe + 4Н2О
Реакцию, протекающую в направлении слева направо, принято называть прямой, противоположную реакцию — обратной.
Характерная особенность обратимых реакций заключается в том, что они не доходят до конца, если продукты реакции не удаляются из сферы взаимодействия (например, при реакциях между газами в закрытом сосуде).Исходные вещества, если даже они были взяты в эквивалентных количествах, никогда не расходуются полностью на образование продуктов реакции. Реакция идет лишь до известного предела и затем как бы останавливается.
Иллюстрируем это явление конкретным примером. При высокой температуре углекислый газ и водород взаимодействуют друг с другом, образуя окись углерода и воду. Эта реакция обратима и выражается уравнением
СО2 + Н2 ⇄СО + Н2О
Опытным путем установлено, что если смешать одну грам-молекулу углекислого газа с одной граммолекулой водорода и нагреть смесь до 1200°, то предел реакции наступает при образовании 0,6 граммолекулы окиси углерода и такого же количества паров воды. Следовательно, из взятых веществ остаются непрореагировавшими 0,4 граммолекулы углекислого газа и 0,4 граммолекулы водорода:
СО2 + Н2 ⇄ СО + Н2О
Первоначальные количества реагирующих веществ (в г-молях)….. 1 1 0 0
Количества веществ по достижении предела реакции (в г-молях)…… 0,4 0,4 0,6 0,6
Нетрудно понять, что причиной «остановки» разбираемой нами реакции является наличие обратной реакции. В самом деле, после смешения углекислого газа с водородом между ними начинается взаимодействие, в результате которого образуются молекулы окиси углерода и воды. По мере течения этой реакции концентрации взятых веществ уменьшаются и скорость реакции становится все меньше и меньше. В то же время возникает возможность обратной реакции. Молекулы окиси углерода и воды, сталкиваясь между собой, могут снова превращаться в молекулы углекислого газа и водорода. Вначале, пока молекул окиси углерода и воды еще мало, их столкновения происходят довольно редко. Однако по мере накопления молекул этих веществ столкновения становятся все чаще, в результате чего скорость обратной реакции постепенно увеличивается. Наконец, наступает момент, когда скорости прямой и обратной реакций уравниваются, т. е. в каждую единицу времени исчезает столько же молекул углекислого газа и водорода, сколько их появляется вновь вследствие обратной реакции. С этого момента концентрации всех четырех газов перестают изменяться, несмотря на то, что первоначально взятые углекислый газ и водород целиком не прореагировали.
Если бы мы исходили не из углекислого газа и водорода, а из окиси углерода и воды, то пришли бы к тому же результату.
Такое состояние системы реагирующих веществ, когда концентрации их не изменяются, называется химическим равновесием. Химическое равновесие достигается тогда, когда скорость прямой реакции становится равной скорости обратной реакции.
Нам представляется, что реакция остановилась и не идет дальше. Однако эта остановка только кажущаяся; обе реакции продолжают идти, но одна из них сводит на нет результаты другой.
Так как химическое равновесие обусловливается не прекращением реакции, а равенством скоростей двух противоположных процессов, то оно является по существу равновесием динамическим. Его можно сравнить, например, с равновесием воды в баке при одновременном вливании и потреблении ее. Если поступление воды в бак равно ее расходу, то количество воды в баке перестает изменяться, совершенно так же, как перестает изменяться количество каждого из веществ при наступлении химического равновесия.
Установившееся между данными веществами химическое равновесие может сохраняться при неизменных условиях как угодно долго. Но стоит только изменить концентрацию хотя бы одного из участвующих в реакции веществ, как равновесие тотчас же нарушается и концентрации всех остальных веществ тоже начинают изменяться.
Введем, например, в сосуд, в котором находятся в равновесии углекислый газ, водород, окись углерода и пары воды, еще некоторое количество углекислого газа. Увеличение концентрации углекислого газа, очевидно, ускорит реакцию, идущую вправо, сообщив ей временный перевес над обратной реакцией. Вследствие этого концентрации углекислого газа и водорода начнут постепенно уменьшаться, а концентрация окиси углерода и воды увеличиваться. Это изменение концентраций будет продолжаться до тех пор, пока накопление молекул окиси углерода и воды, с одной стороны, и убыль углекислого газа и водорода, с другой — не уравняют скорости обеих реакций. Тогда вновь установится равновесие, но уже при иных, чем раньше, концентрациях всех четырех веществ.
Процесс изменения концентраций, вызванный нарушением равновесия, называется смещением или сдвигом равновесия.
Если при этом происходит увеличение концентраций веществ, стоящих в правой половине уравнения (и, конечно, одновременно уменьшение концентраций веществ, стоящих слева), то говорят,
что равновесие смещается вправо или в направлении течения прямой реакции; при обратном изменении концентрации говорят о смещении равновесия влево. Например, в разобранном выше случае равновесие смещается вправо, так как увеличивается концентрация окиси углерода и воды.
Выразим теперь условие наступления равновесия в математической форме.
Предположим, что происходит обратимая реакция, выражающаяся общим уравнением:
A + B⇄C+D
где А и В — два вещества, из которых образуются два новых вещества С и D. Обозначим концентрации этих веществ соответственно через [А], [В], [С] и [DL Скорость реакции, идущей в направлении верхней стрелки, обозначим через υ1, скорость обратной реакции через υ2. Так как скорость реакции пропорциональна произведению концентраций реагирующих веществ, то для прямой реакции
υ 1 = K1 ∙ [А] ∙ [В]
Точно так же для обратной реакции
υ2 = К2 ∙ [С] • [D]
При установившемся равновесии скорости равны, т. е.
K1 ∙ [А] ∙ [В] = К2 ∙ [С] ∙ [D]
Преобразуя это уравнение, получаем:
Так как К1 и К2 постоянные величины, то отношение их тоже постоянная величина. Обозначив ее буквой К,получим:
где [С], [D], [А] и [В] обозначают концентрации соответствующих веществ при равновесии.
Постоянная К называется константой равновесия. Это характерная для каждой реакции величина, не зависящая от концентраций, но изменяющаяся с температурой. Физический смысл ее нетрудно понять, если принять во внимание, что она равна отношению К1 : К2 и, следовательно, показывает, во сколько раз прямая реакция идет быстрее обратной при одинаковой температуре и концентрациях, равных единице.
Выведенное уравнение является математическим выражением закона действия масс применительно к обратимым реакциям. Смысл его можно формулировать так:
При обратимых реакциях равновесие наступает тогда, когда произведение концентраций образующихся веществ, деленное на произведение концентраций веществ, вступающих в реакцию, станет равным некоторой постоянной для данной реакции при данной температуре величине.
Если вещества участвуют в реакции в количестве нескольких молекул:
mA + nB = pC + qD
то уравнение константы равновесия принимает следующий вид:
Если в реакции участвуют твердые вещества, то концентрации их не входят в выражение константы равновесия по той же причине, по какой не входят они в выражение скорости реакции. Так, например, для реакции между углекислым газом и накаленным углем .
CO2 + C ⇄ 2CO
константа равновесия выразится отношением:
Равновесие указанной реакции может быть нарушено только путем изменения концентрации углекислого газа или окиси углерода; ни увеличение, ни уменьшение количества угля не оказывает никакого влияния на состояние равновесия.
Пользуясь уравнением константы равновесия, легко определить, как сместится равновесие при изменении концентрации того или иного из реагирующих веществ. Покажем это на примере уже знакомой нам реакции между углекислым газом и водородом.
Константа равновесия этой реакции выразится уравнением
Положим, что после того как равновесие установилось, мы увеличили концентрацию водорода в смеси газов. Так как отношение для данного процесса постоянно, то увеличение знаменателя дроби (концентрации водорода) должно нарушить равновесие и ускорить реакцию, которая будет способствовать уменьшению знаменателя при одновременном увеличении числителя, т. е. реакцию превращения молекул углекислого газа и водорода в молекулы окиси углерода и воды.
Когда в результате ускорения этой реакции восстановится прежнее соотношение между реагирующими веществами, снова наступит равновесие, но при этом концентрация углекислого газа окажется меньше, чем она была до прибавления водорода, а концентрации паров воды и окиси углерода увеличатся. Такой же результат, очевидно, получится при увеличении концентрации углекислого газа (как мы установили еще раньше) или при уменьшении концентрации окиси углерода или паров воды. Во всех этих случаях равновесие будет смещаться в сторону образования окиси углерода и паров воды. Наоборот» увеличение концентраций окиси углерода и паров воды или уменьшение концентраций углекислого газа и водорода вызовет обратный эффект, т. е. смещение равновесия в сторону образования новых количеств углекислого газа и водорода. Из всего сказанного можно сделать два очень важных вывода:
1. Чтобы возможно полнее использовать одно из вступающих в обратимую реакцию веществ, надо действовать на него избытком другого вещества.
2. Если один из продуктов реакции по мере его образования будет удаляться из сферы взаимодействия, то равновесие будет непрерывно смещаться в сторону образования этого продукта и, таким образом, обратимая реакция практически может быть доведена до конца.
Так, например, если непрерывно удалять из реакционной смеси образующуюся при взаимодействии углекислого газа и водорода воду, то можно полностью превратить эти газы в окись углерода и пары воды.
Точно так же при пропускании водорода над накаленной железной окалиной (см. стр. 190) последняя целиком превращается в металлическое железо, так как образующийся при реакции водяной пар непрерывно удаляется из сферы реакции вместе с избытком водорода. В закрытом сосуде эта же реакция не доходит до конца.
Постоянство соотношения между концентрациями реагирующих веществ при равновесии дает возможность производить целый ряд очень важных расчетов. Приведем несколько типичных примеров таких расчетов для простейших реакций.
Пример 1. Обратимая реакция выражается уравнением: A+ B⇄2C. При установившемся равновесии концентрации всех трех веществ были: [A] = [B] = 3моль/л; [С] = 4 моль/л. Вычислить константу равновесия и начальные концентрации веществ А и В.
Для данной реакции константа равновесия выражается уравнением
Подставив сюда величины концентраций, находим:
Чтобы определить начальные концентрации веществ А и В, нужно учесть, что согласно уравнению реакции из одной молекулы А и одной молекулы В образуются две молекулы С. Отсюда следует, что на образование 4 молей С расходуется 2 моля А и 2 моля В. Таким образом, начальные концентрации А и В равнялись 5 молям на литр каждая.
Пример 2. Константа равновесия для реакции А + В ⇄ С + D равна двум. Вычислить концентрации всех четырех веществ при равновесии, если начальные концентрации веществ А и В были:
[А] = 5 моль/а; [В] =Л моль/л
Из уравнения реакции видно, что из каждой граммолекулы А и В образуется по одной граммолекуле С и D. Обозначим число прореагировавших молей А и В через х. Тогда концентрации всех четырех веществ при равновесии выразятся следующим образом:
[C] = [D] = х; [А] = 5 — х; [В] = 1 — х Подставив эти величины в уравнение константы равновесия, получим:
Отбрасывая первое решение как невозможное, находим концентрации при равновесии:
[С] = [D] = 0,9 моль/л; [А] = 4,1 моль/л; [В] =0,1 моль/л Нетрудно убедиться, что при этих условиях
Вы читаете, статья на тему Химическое равновесие

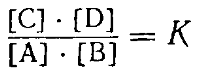
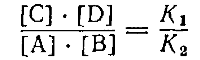
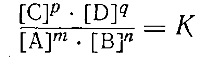
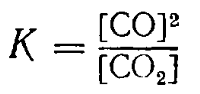
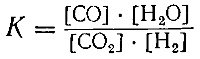
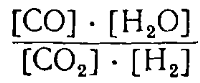
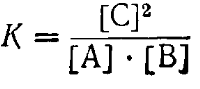
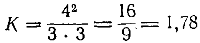
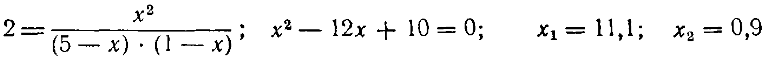
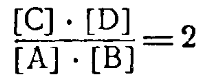
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.