Термохимия
Энергия при химических превращениях, как известно, может выделяться или поглощаться в различных формах:
В виде тепла.
Света.
Электричества и т. д.
Количественное изучение тепловых изменений, сопровождающих химические реакции, составляет задачу специального раздела химии, называемого термохимией.
Для измерения тепловых эффектов химических реакций пользуются специальными приборами, называющимися калориметрами.
Простейший калориметр представляет собой сосуд с хорошей термоизоляцией, наполненный точно взвешенным количеством воды.
Реакция проводится в реакционной камере, помещенной в калориметр.
Выделяющееся при реакции тепло передается воде, температура которой до и после реакции измеряется чувствительным термометром.
Произведение из величины повышения температуры на теплоемкость воды и калориметра служит мерою выделяющегося при реакции тепла.
В практическом отношении особенно важным является определение количества тепла, выделяющегося при сжигании различных веществ.
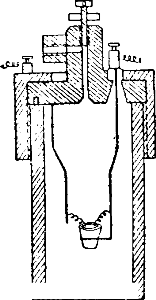
Эти определения производятся при помощи так называемой калориметрической бомбы (рис.), представляющей собой закрытый сосуд, изготовленный из прочной стали и способный выдерживать давление в несколько десятков атмосфер.
Бомба помещается в калориметр. Сжигаемое вещество вносят в бомбу, наполняют последнюю кислородом под давлением и вызывают реакцию с помощью электрического запала.
Количество выделившегося тепла определяется по повышению температуры воды в калориметре.
Основной принцип, на котором основываются все термохимические расчеты, установлен русским академиком Г. И. Гессом в 1840 г.
Этот принцип, известный под названием закона Гесса, может быть сформулирован так:
Тепловой эффект реакции зависит только от начального и конечного состояний реагирующих веществ, но не зависит от промежуточных стадий процесса.
Поясним это примером. Разбавленный раствор сульфата натрия Na2SО4 можно приготовить из серной кислоты, едкого натра и воды различными способами.
Например:
- Смешать разбавленный раствор, содержащий две грам молекулы NaOH, с раствором, содержащим одну грам молекулу H2SO4;
- К раствору, содержащему одну грам молекулу H2SO4, прибавить раствор, содержащий одну грам молекулу NaOH, и таким образом получить сперва раствор кислой соли NaHSО4, затем к раствору кислой соли прибавить раствор еще одной грам молекулы NaOH.
Тепловые эффекты происходящих в этих двух случаях реакций таковы :
Первый способ:
2NaOH(aq) + H2SО4 (aq) = Na2SО4(aq) + 2Н2О(ж) + 31,4 ккал
Второй способ:
NaOH(aq) + H2SО4(aq) = NaHSО4(aq) + Н2О(ж) + 14,75 ккал
NaHSО4(aq) + NaOH(aq) = Na2SО4(aq) + Н2О(ж) + 16,65 ккал
Всего 31,4 ккал
Таким образом, общее количество тепла, выделившегося при образовании одной грам молекулы сульфата натрия, в обоих случаях одинаково, хотя во втором случае реакция протекала в две стадии.
Закон Гесса
Закон Гесса дает возможность вычислять тепловые эффекты реакций в тех случаях, когда они почему-либо не могут быть измерены.
Обычный прием, применяемый при таких расчетах, заключается в разбивке сложной реакции на отдельные стадии.
Вычисление искомого теплового эффекта основано на том, что общее количество тепла, выделяемого (или поглощаемого) при данной реакции, есть алгебраическая сумма количеств тепла, выделяемых (или поглощаемых) при последовательных стадиях реакции.
При расчетах нужно всегда помнить, что теплота образования сложного вещества из простых веществ равна его теплоте разложения, взятой с обратным знаком.
Пример применения закона Гесса
Хорошим примером применения закона Гесса может служить вычисление теплоты образования окиси углерода из простых веществ — угля и кислорода.
Тепловой эффект этой реакции не может быть определен непосредственно из опыта, так как уголь сгорая, превращается в углекислый газ, а не в окись углерода.
Но его можно рассчитать, зная теплоту образования углекислого газа из угля и кислорода (94 ккал) и теплоту сгорания окиси углерода (67,6ккал).
Реакция горения угля выражается термохимическим уравнением:
С(т) + Оа(г) = С02(г) + 94 ккал
Разбиваем эту реакцию на стадии, допуская, что уголь сгорает до окиси углерода, которая затем, в свою очередь, сгорает, образуя углекислый газ.
Обозначив теплоту образования окиси углерода через х, пишем уравнения для отдельных стадий реакции и складываем их:
СО + (1 : 2) O2 = CO + x ккал
CO + (1 : 2) O2 = CO2 + 67,6 ккал
C + O2 = CO2 + x ккал + 67,6 ккал
Сравнивая полученное уравнение с написанным выше, находим:
х + 67,6 ккал = 94 ккал
откуда
х =26,4 ккал
Следовательно, теплота образования окиси углерода из угля и кислорода равна 26,4 ккал.
Полученный результат очень интересен.
Он показывает, что присоединение второго атома кислорода к атому углерода сопровождается выделением гораздо большего количества тепла, чем присоединение первого атома.
Это можно объяснить тем, что при окислении углерода прежде всего нужно разрушить связь между атомами углерода.
На эту работу затрачивается большая часть той энергии, которая освобождается при соединении атома углерода с первым атомом кислорода, и лишь остающаяся энергия выделяется в виде тепла.
При сгорании угля в окись углерода выделяется немногим больше четвертой части того количества тепла, которое дает полное сгорание угля.
Отсюда понятно экономическое значение полного сгорания топлива.
Присутствие большого количества окиси углерода в выпускаемых на воздух дымовых газах указывало бы на потерю значительной части той энергии, которая содержалась в сгоревшем угле.
Для усвоения термохимических расчетов вычислим еще тепловой эффект реакции горения метана СН4, исходя из следующих данных:
- Теплота образования метана 17,9 ккал.
- Теплота образования воды 68,3 ккал.
- Теплота образования углекислого газа 94 ккал.
Обозначив искомый тепловой эффект через х, составляем уравнение реакции горения метана:
СН4(г) + 2О2(г) = СО2(г) + 2Н2О(ж) + х ккал
Разбиваем реакцию на стадии. Представим себе, что метан сначала разлагается на водород и уголь, а затем уголь и водород соединяются с кислородом, образуя воду и углекислый газ.
Учитывая, что теплота образования метана равна 17,9 ккал и, следовательно, при разложении его столько же тепла должно поглощаться, составляем уравнения для отдельных стадий реакции и суммируем их:
СН4 = С + 2Н2— 17,9 ккал
С + О2=СО2 + 94 ккал
2Н2 + О2 = 2Н2О + 2 • 68,3 ккал
СН4 + 2О2=СО2 + 2Н2О + 212,7 ккал
Разобранный нами пример вычисления теплового эффекта реакции является иллюстрацией следующего общего положения вытекающею из закона Гесса:
Тепловой эффект химической реакции равняется сумме теплот образования получающихся веществ за вычетом, суммы теплот образования вступающих в реакцию веществ.
Это положение позволяет упростить многие термохимические расчеты.
Так, например, последнюю задачу можно решить следующим образом.
Составив уравнение реакции горения метана и обозначив искомый тепловой эффект через х,подписываем под формулами веществ значения их теплот образования:
СН4(г)(17,9 ккал) + 2О2(г) = СО2(г)(94 ккал) + 2Н2О(ж)(2•68,3 ккал) +х ккал
Отсюда:
х = 94′ + 2 • 68,3 — 17,9 = 212,7 ккал

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.